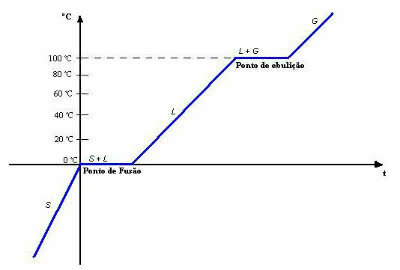
Кад изговоримо реч „равнотежа“, падне нам на памет предмет који остаје неограничено. Међутим, ово је само једна врста равнотеже, тзв „Статичка равнотежа“.
Ту је и "динамичка равнотежа". У њему, као што и само име каже, нема ниједног тренутка у коме се предмет или појава још увек налази. На пример, да бисте разумели, погледајте доњу илустрацију и имајте на уму да је количина воде која падне у посуду једнака количини која из ње тече, одржавајући ниво воде константним. У том случају кажемо да постоји динамичка равнотежа, равнотежа у покрету.

Ова врста равнотеже се дешава у реверзибилне реакције, односно у оним реакцијама које се јављају у оба смера. Истовремено када се молекули реактаната трансформишу у производе, молекули производа реагују једни са другима да би створили реактанте. Реверзибилност реакције представљена је стрелицама у оба смера:
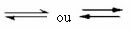
Када је брзина развоја директне реакције (формирања производа) једнака брзини развоја инверзна реакција (стварање реактаната), под константном температуром, значи да је реакција достигла равнотежу хемијска.
А у случају реакција са присуством само молекула у реактантима и производима, имамо а молекуларна равнотежа.Не заустављај се сада... После оглашавања има још;)
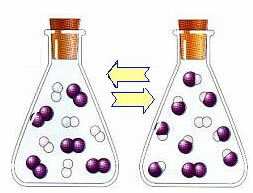
Следи пример реакције која се дешава између гасовитог водоника (Х2) и гасовити јод (И.2), за формирање гаса водоникодододида (ХИ):
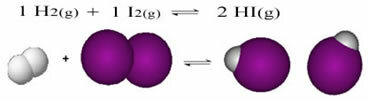
На почетку реакције, брзина развоја директне реакције је била већа, пошто су концентрације реактаната биле максималне, а производа нула. Тако да је и стопа развоја обрнуте реакције била нула.
Међутим, током времена гасови водоник и јод реагују, стварајући производ. На тај начин концентрација реагенса почиње да опада, а њихов степен развоја такође опада.
Како се концентрација производа повећава, а концентрација реактаната смањује, брзина развоја инверзне реакције почиње да расте. Ако се температура одржава константном, доћи ће време када ће две брзине развоја остати исте, показујући тако да је реакција достигла хемијску молекуларну равнотежу.
Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да се на овај текст упутите у школи или академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Молекуларна равнотежа“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm. Приступљено 28. јуна 2021.