Хессов закон створио је швајцарски хемичар Гермаин Х. Хесс (1802-1850), који се сматра једним од оснивача термохемије. Његов закон је рекао:

Односно, ΔХ зависи само од вредности енталпије реагенса и производа, као у изразу:
| ΔХ = ΔХреагенси + ΔХпроизводи |
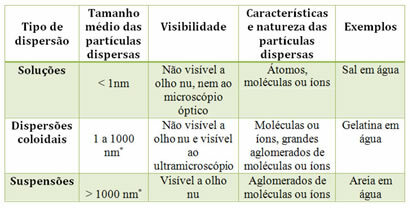
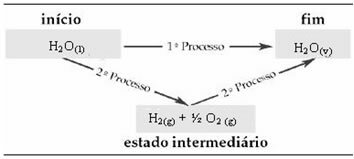
На пример, размотрите реакцију где 1 мол воде (Х2О) претвара се у воду у гасовитом стању. Ова реакција се изводи два пута; међутим, изабрани су различити путеви:
(1.) Изведено је у једном кораку:
Х.2О.(1) → Х.2О.(в) ΔХ = +44 кЈ
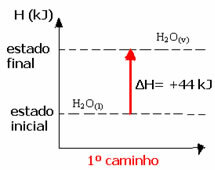
(2.) Извршено је у две фазе:
1. корак: Х.2О.(1) → Х.2 (г) + ½ тхе2 (г) ΔХ = +286 кЈ
2. фаза: Х.2 (г) + ½ тхе2 (г) → Х.2О.(в) ΔХ = -242 кЈ
Х.2О.(1) → Х.2О.(в) ΔХ = +44 кЈ
Не заустављај се сада... После оглашавања има још;)
Имајте на уму да је без обзира на то да ли је извршен један или два корака, промена енталпије (ΔХ) увек 44 кЈ. То је зато што је ΔХ алгебарски зброј вредности валоресХ корака који чине процес, односно међупроцеса:
| ΔХ = ΔХ1 + ΔХ2 + ΔХ3 + ... |
На пример, у другом случају, укупни ΔХ реакције био је збир ΔХ првог корака (ΔХ = +286 кЈ) са оним другог (ΔХ = -242 кЈ). Тако смо у једном кораку добили исту вредност реакције:
ΔХ = (+286 + (-242)) кЈ
ΔХ = (+286 -242) кЈ
ΔХ = +44 кЈ
Стога нас занимају само почетне и коначне вредности. У овом случају почетно стање одговара Х.2О.(1) и крај Х.2О.(в).
Овај закон је постао веома важан у термохемији, јер се одређеним хемијским реакцијама не може експериментално одредити ΔХ. Међутим, према Хесс-овом закону, енталпија ове врсте реакције може се израчунати из енталпија других реакција (интермедијарних реакција).
Јеннифер Фогаца
Дипломирао хемију
Бразилски школски тим
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Хесов закон“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/lei-hess.htm. Приступљено 28. јуна 2021.