Батерија то је систем у коме се хемијска енергија спонтано трансформише у електричну енергију.
1836. године енглески хемичар и метеоролог Џон Фредерик Данијел (1790-1845) саградио је гомилу различиту од оне познате у то време: гомилу Алесандра Волте. На овој гомили он међусобно повезане две електроде, које су представљале системе који се састоје од метала уроњеног у водени раствор соли створене катионима овог метала.
Једна од електрода, бакарна електрода, састојала се од бакарне плоче умочене у раствор бакар сулфата (ЦуСО4). Друга електрода је била цинкова електрода, која се састојала од цинкове плоче уроњене у раствор цинковог сулфата (ЗнСО4).
Ове две електроде биле су међусобно повезане електричним кругом који је садржао лампу, јер ако би се укључила, то би указивало на појаву електричне струје.
Такође, између њих је био слани мост. Овај мост се састојао од стаклене цеви у облику слова У која је садржала концентровани водени раствор високо растворљиве соли, као што је, на пример, калијум хлорид (КЦл (ак)). Крајеви цеви пресвучени су памуком или агаром.
Испод имамо структуру ове ћелије или електрохемијске ћелије, која је постала позната као Данијелова ћелија. Сећајући се да се свака електрода назива полућелија.
Са затвореним кругом, лампица се укључује и након неког времена, цинкова плоча је кородирала и маса јој се смањила, док је бакарна плоча супротно, њена маса се повећава (као што је приказано на доњој слици). Такође се примећује да долази до повећања концентрације у мол / Л јона Зн2+ и смањење јона Цу2+.
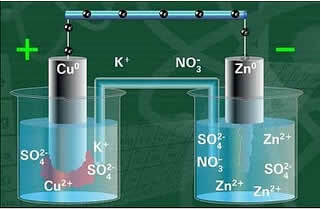
Даниелл-ова шема стека.
Зашто се ово дешава?
Не заустављај се сада... После оглашавања има још;)
Да бисмо разумели, погледајмо реакције које се одвијају на свакој електроди посебно.
У цинковој електроди долази до следеће реакције равнотеже:
Зн (с) ↔ Зн2+(овде) + 2 и-
То значи да метални цинк (из плоче) подлеже оксидацији, односно донира два електрона катиону цинка (из раствора) и постаје Зн2 +. Такође се дешава супротно, катион кинк присутан у раствору прима два електрона донирана од цинка и постаје метални цинк. Због тога постоји непрекидни процес оксидације и редукције.
Исто се односи и на бакарну електроду која ће имати глобалну реакцију у динамичкој равнотежи: Цу (с) ↔ Цу2+(овде) + 2 и-
Даниелл је схватио да ако повеже ове две електроде, реактивнија ће донирати своје електроне мање реактивном катиону, уместо да то ради са катионима у свом решењу. У овом случају, цинк је најреактивнији и подвргава се оксидацији, донирајући електроне бакару, отуда и смањење његове масе. Електрода која се подвргава оксидацији је негативни пол, који се назива анода. Бакарна електрода је она која пролази кроз редукцију, катион бакра прима два електрона из цинка и назива се катода (позитивни пол).
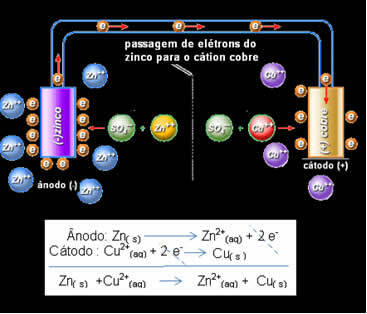
Пролаз електрона и глобална једначина Даниелова слога.
Изнад имамо глобалну једначину за овај стог, која се добија додавањем две полуреакције. Његов приказ или хемијска нотација направљени су према следећем правилу:

Дакле, за Даниелл-ов стацк имамо:
Зн / Зн2+// Асс2+ / асс
Јеннифер Фогаца
Дипломирао хемију
Бразилски школски тим
Физичко-хемијска - Хемија - Бразил Сцхоол
Да ли бисте желели да се на овај текст упутите у школи или академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Данилова гомила“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Приступљено 28. јуна 2021.