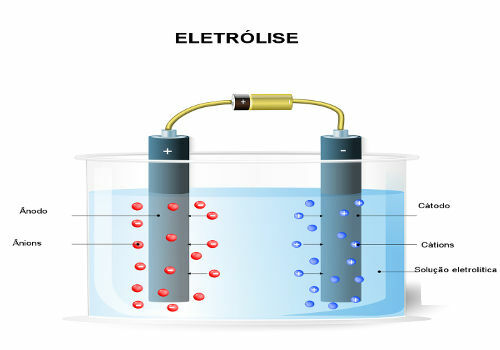
Електролиза воде састоји се од разградње ове супстанце помоћу електричне струје и додавања електролита. Хајде да боље разумемо како се то догађа?
Прочитајте и ви: Шта је електролиза?
Како се дешава електролиза воде?
Молекули воде су способни за самојонизацију, генеришући Х јоне+ (или Х.3О.+) и ох-:
Х.2О ↔ Х+ + ОХ-
или
2 сата2О ↔ Х3О.+ + ОХ-
Међутим, вода је врло слаб електролит и упркос томе што има ове јоне, не може да проводи електрична струја. Дакле, да би се извршила његова електролиза, односно њено разлагање помоћу електричне струје, потребно је додати електролит, јонску растворену супстанцу која може бити сол, база или киселина.

Приоритетни налог за селективно испуштање
Међутим, како је објашњено у тексту Водена електролиза, у овом случају, нећемо имати само јоне који долазе из воде, већ и оне супстанце која је у њој растворена. У електролизи се на електроди празни само један катион и један анион, то јест а селективно испуштање по редоследу приоритета.
Дакле, да би катода и анода које се празне биле воде, а не растворене супстанце, потребно је одабрати киселина, база или сол чији се јони лакше испуштају из електрода од јона у води. Да бисмо то урадили, треба да се обратимо приоритетном реду приказаном доле:
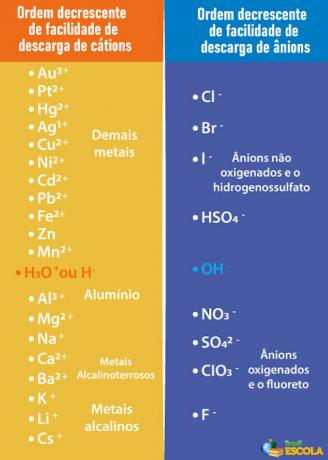
Имајте на уму да су катјони наведени испод Х.+ имају мање лакоће истовара од њега. У табели са десне стране видимо да су аниони испод ОХ- имају мању лакоћу истовара. Стога можемо одабрати, на пример, сол, базу или киселину која формира јоне На.+, К+, НА3-, САМО42- и тако даље, поред тога што такође формирају исте јоне као и вода, то јест Х.+ и ох-. Неки примери су: сумпорна киселина (Х2САМО4), натријум хидроксид (НаОХ) и калијум нитрат (КНО3).
Не заустављај се сада... После оглашавања има још;)
Пример са реакцијама које су се догодиле у електролизи воде
Рецимо да се врши електролиза воде са додатком сумпорне киселине. У овом случају, у средини ћемо имати формирање следећих јона:
Дисоцијација киселине: 1 Х.2САМО4 → 2 Х.+ + 1 СО42-
Аутојонизација воде: Х.2О → Х.+ + ОХ- или 2 сата2О → Х.3О.+ + ОХ-
Имајте на уму да је једини постојећи катион Х.+, па ће управо он претрпети смањење (добитак од електрони) на негативној електроди (катоди) и произвешће гас водоникО. (Х.2).
Када говоримо о анионима, у средини су два аниона, који су ОС42- и ох-. Као што показује горња табела, ОС42- реактивнији је и мање га је лако испразнити. Дакле, ОХ- празниће се, оксидирајући (губећи електроне) у позитивној електроди (аноди) и производиће гас кисеоник(О.2):
Полуреакција катоде: 4 Х3О.+ + 4 и- → Х.2О + Х2
Полуреакција аноде: 4 ОХ- → 2 Х.2О + 1 О.2 + 4 и-
Сабирањем читавог овог процеса, долазимо до глобалне једначине:
Јонизација воде: 8 Х.2О → 4 Х.3О.+ + 4 ОХ-
Полуреакција катоде: 4 Х3О.+ + 4 и- → 4 Х.2О + 2 Х.2
Полуреакција аноде: 4 ОХ- → 2 Х.2О + 1 О.2 + 4 и-
Глобална једначина: 2Х2О → 2 Х.2 + 1 О.2
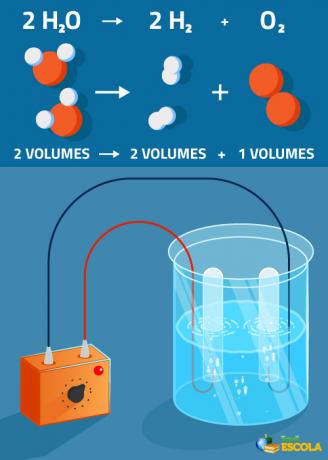
Имајте на уму да је количина произведеног водоника двоструко већа од количине кисеоника. Међутим, у пракси ова строга пропорција није потврђена јер је кисеоник растворљивији од гаса водоник.
Прочитајте такође: Добијање алуминијума електролизом
Примене водене електролизе
Електролиза воде је веома важан процес, с обзиром на то да је водоник гас који се може користити као гориво. Као нафтна горива нису обновљиви, гас водоник би могао постати важна алтернатива.
Поред тога, већ постоје методе производње бензина које користе поступак електролизе воде. Погледајте како се то ради у тексту Научници могу угљен-диоксид претворити у бензин.
Јеннифер Фогаца
Наставник хемије
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Електролиза воде“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/eletrolise-agua.htm. Приступљено 28. јуна 2021.
Хемија

Примене електролизе, галванизације, никловања, хромирања, никла, хрома, катоде, натријума, алуминијума, хлора, каустична сода, гас водоник, магматска електролиза, водена електролиза, алкални метали, земноалкална земља, гас хлор.
Хемија

Електролиза, раствори електролита, електрична струја, реакције редукције оксидације, спонтани хемијски процес, хемијски процес неспонтан, трансформатор, вештачка трансформација, индустрије, алкални метали, земноалкална земља, гас водоник, гас цл