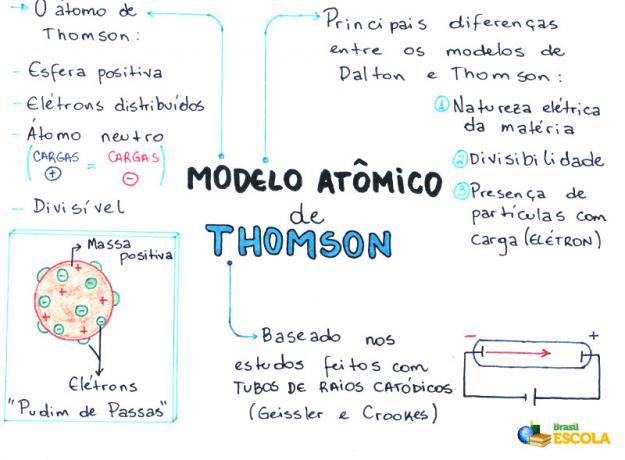
О. Тхомсон-ов атомски модел је 1898. године предложио енглески физичар Џозеф Џон Томсон или, једноставно, Џеј Џеј Томсон. После неколико експериментални докази о постојању електрона, преврнуо је теорију недељивости атома коју је предложио Јохн Далтон.
Тхомсон је на основу свог модела потврдио и доказао постојање електрони (честице са негативним електричним набојем) у атому, односно атом има субатомске честице.
Мапа ума: Атомски модел Тхомсон
* Да бисте преузели мапу ума у ПДФ-у, Кликните овде!
Тхомсон је предложио свој атомски модел на основу открића везаних за радиоактивност и експеримената изведених са катодном цевчицом коју су изградили научници Геисслер и Цроокес. Погледајте приказ ове цеви:
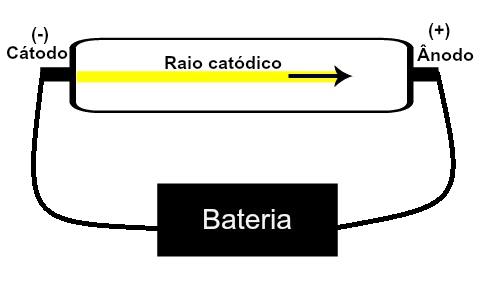
Када је разређени гас ниског притиска изложен високом електричном напону (нпр. 15000 В), он ствара а сноп светлости (састављен од електричних наелектрисања) од катоде (негативни пол) ка аноди (пол позитиван).
Овим експериментом Тхомсон је дошао до закључка да када су атоми гасовитог материјала унутра цеви су били подвргнути високом напону, њихови електрони су истргнути и усмерени на плочу позитивно.
Разматрања која је предложио Тхомсон-ов атомски модел
Експериментима изведеним са катодном цевчицом, Тхомсон је предложио своје тумачење како би био атом и његова конституција. Дакле, према њему:
- Атом је сфера, али није масиван како је предложио Џон Далтон атомски модел;
- Атом је неутралан, јер је сва материја неутрална;
- Како атом има електроне који имају негативне наелектрисања, он стога мора имати позитивне честице тако да коначни набој буде нула;
- Електрони нису фиксирани или заробљени у атому, они се под одређеним условима могу пренети на други атом;
- Атом се може сматрати континуираном течношћу са позитивним наелектрисањем где би се распоређивали електрони који имају негативан набој;
- придружио свој модел на пудинг од грожђица (који представљају електроне);
- Како се електрони који су расејани имају исти набој, између њих постоји међусобна одбојност, што их чини равномерно распоређеним у сфери.
Новости које је атом предложио Тхомсон моделом
Тхомсон-ов атомски модел био је други предложени за атом. Први модел формулисао је Јохн Далтон.
Не заустављај се сада... После оглашавања има још;)
Томсонов модел бавио се новим сазнањима о атому која до тада нису била предложена због недостатка научне основе, као што су:
- Електрична природа материје;
- Сплитабилност атома;
- Присуство малих, наелектрисаних честица у атому.
Проблеми на које је указан атом Томсона
Неколико физичара у време предлога Тхомсон-ов атомски модел, заснован на теоријама класичне физике, указао је на неке недоследности присутне у овом моделу:
- Тхомсон је предложио да атом има стабилност у односу на равномерну расподелу електрона, која се може модификовати утицајем енергије. Међутим, Класична физика, на основу електромагнетизам, не дозвољава постојање стабилног система заснованог само на одбијању између честица истог наелектрисања;
- За Томсона су електрони равномерно распоређени у атому, али имају способност да померају се убрзано и, према томе, морају емитовати електромагнетно зрачење на одређеним фреквенцијама специфична. Међутим, ово није примећено.
- Томсонов модел је често био неефикасан у објашњавању атомских својстава као што су њихов састав и организација.
* Минд Мап, Вицтор Рицардо Ферреира
Наставник хемије
Ја сам, Диого Лопес Диас
Да ли бисте желели да се на овај текст упутите у школи или академском раду? Погледајте:
ДАНИ, Диого Лопес. „Тхомсон-ов атомски модел“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/o-atomo-thomson.htm. Приступљено 27. јуна 2021.
Хемија

Ниелс Бохр, Боров атом, атомска физика, стабилни атом, атомски модел, планетарни систем, слојеви електросфере, нивои енергије, електронске љуске, енергија електрона, Рутхерфорд-ов атомски модел, атом побуђеног стања.
Хемија

Атоми и конструкција универзума, атомска теорија, да је све направљено, материју чине атоми, теорија четири елемента, древни алхемичари, атомска теорија, темељна честица.