Радиоактивност је својство које воле неки атоми уранијум и радио, морају да издају спонтано енергије у облику честице и талас, постајући хемијски елементи стабилнији и лакши.
Врсте
Радиоактивност се представља са два начина различита зрачења: честица - алфа (α) и бета (β); и електромагнетни талас - гама зраци (γ).
алфа зраци: то су позитивне честице састављене од два протона и два неутрона и са малом пенетрационом снагом.
бета зраке: су негативне честице које не садрже масу која се састоји од електрона (занемарљива маса), а њихова пенетрациона снага је већа од снаге алфа зрака, али мања од снаге гама зрака.
Гама: они су високоенергетски електромагнетни таласи и, пошто нису честице, такође немају масу.
Прочитајте и ви: Формуле радиоактивности
Не заустављај се сада... После оглашавања има још;)
Закони
Радиоактивна емисија честица прати одређена понашања која се објашњавају законима радиоактивности (једна за алфа честицу и једна за бета честицу), које је описао хемичар енглески језик Фредерицк Соддии пољски хемичар и физичар Казимиерз Фајанс.
Први закон радиоактивности
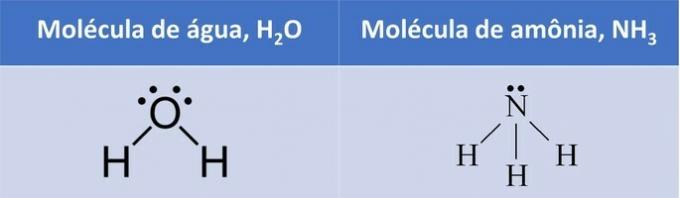
Према овом закону, када радиоактивни атом емитује зрачење алфа типа, настаће а нови атом са језгром која садржи два протона и два неутрона мање, укупно масе четири јединице мање. Први закон радиоактивности можемо представити следећом генеричком једначином:
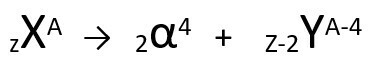
Генеричка једначина првог закона радиоактивности.
Погледајмо пример:
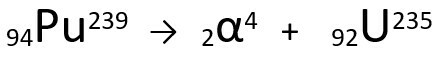
Једначина која представља емисију α-честица Плутонијумом-239.
Имајте на уму да, приликом емитовања алфа зрачења, новонастали атом, Уранијум-235, има масени број за четири јединице мањи и атомски број две јединице мањи - тачно вредности које одговарају α честици коју емитује језгро плутонијума. Да бисте сазнали више о томе, идите на: Први закон о радиоактивности или Први Содијев закон.
Други закон радиоактивности
Други закон говори о бета издање. Када атом емитује бета честицу, која се састоји од електрона и занемариве масе, његова атомска маса остаје непромењен то је твој атомски број повећава се за једну јединицу. Генерално, представљамо следеће:
Генеричка једначина другог закона радиоактивности.
Погледајте пример:
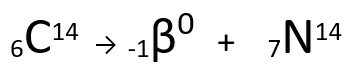
Једначина која представља емисију β-честица угљеником-14.
Може се видети да формирани атом азота има исту масу као и атом Ц-14, односно јесу изобаре, а његов атомски број се повећава за једну јединицу. Повећање у атомски бројобјаснио је научник Хенрицо Ферми, који је предложио да један од неутронима језгра пролази трансмутацију, према следећој једначини, генеришући аелектрона(емитована бета честица), а неутрино(субатомска честица без електричног наелектрисања и без масе,) и а протона(П).
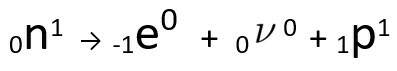
Једначина која представља трансмутацију неутрона, према Фермијевој хипотези.
О. електрона то је неутрино издају се за из језгра, преостали само протона, што објашњава повећање атомског броја Да бисте сазнали више о њему, посетите: Други закон о радиоактивности или Други закон о Соддију.
Прочитајте такође: Разлика између радиоактивног загађења и зрачења
апликације
упркос негативан поглед има талог на радиоактивност важне примене у нашем свакодневном животу, на пример, у производња електрична енергијау нуклеарне електране кроз фисијарадиоактивних атома.
Тренутно Бразил не користи нуклеарна енергија као главни извор енергије, али има нуклеарне електране (Ангра 1 и 2) које раде за снабдевање земље електричном енергијом. Такође можемо поменути и датирање материјала пронашли археолози користећи угљеник-14.

Нуклеарна електрана у Рио де Жанеиру, Бразил
Друга темељна улога коју радиоактивност игра је везана за област медицине, као што је Кс раии у ЦТ скенирање, а такође и код неких врста лечење рака.
Прочитајте и ви: Главни ризици нуклеарне производње електричне енергије по животну средину
природна радиоактивност
свакодневно смо изложени Тхе мале количине зрачења, било вештачког или природног. Природна радиоактивност се у природи јавља спонтано. Део овог зрачења које добијамо долази из хране која се свакодневно конзумира, као што су Радон-226 и Калијум-40, који су представљени у врло низак ниво и не представљају ризик по наше здравље нити штете хранљивим вредностима намирница.
Намењен је овом процесу излагања хране радиоактивним емисијама сачувати храну и промовишу а раст биљке. Неки примери хране која емитује зрачење су: Бразилски ораси, банана, пасуљ, црвено месо, између осталог.
Откриће
Проучавање радиоактивности започело је истраживањем немачког физичара Вилхелм Роентген, 1895, када је истраживао ефекатлуминисценција. Још један важан научник за развој радиоактивности био је француски физичар Антоине-Хенри Бецкуерел, који је 1896. године приметио ознаке на фотографском филму на узорку уранијумове соли.
Међутим, то је било Цурие пар који је први пут употребио термин радиоактивност. У 1898, лак Марие Цурие наставили су студије о радиоактивности и открили драгоцена открића за ово подручје, попут открића два нова радиоактивна елемента: полонијума (По) и радијума (Ра).
Постериорно, Ернест Рутхерфорд открио зрачење алфа типа (α) и бета (β), који је омогућио боља објашњења свог атомског модела, као и напредак истраживања у вези са радиоактивношћу.
Прочитајте такође:Марија Кири: биографија, прилози и заоставштина
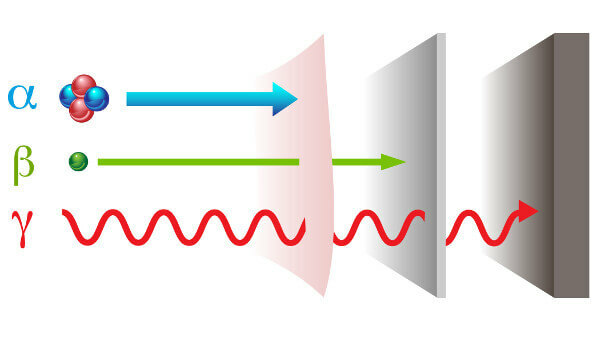
Врсте зрачења и њихове пенетрационе моћи.
пропадање
О. радиоактивног распада (или трансмутација) је природни процес где један нестабилно језгро емитује зрачење, сукцесивно, да би смањите своју енергију и постају стабилни.
То се обично дешава са атомима атомског броја. веће од 84, који су атоми са велика нестабилност нуклеарни због количине позитивног наелектрисања (протона) акумулираног у језгру. У овом процесу, неутрони нису довољни да би се стабилизовали сви протони скупљени у језгру, а затим језгро почиње да се подвргава радиоактивном распаду све док његов атомски број не буде мањи од 84.
У неким случајевима се може догодити да атоми са атомским бројем мањим од 84 имају нестабилна језгра и такође пролазе кроз процес распадања, али за то треба да имају одређени број протона знатно изнад броја неутронима.
Радиоактивни распад је израчунато по полуживоту (или период полуразградње, П) радиоизотоп, што је време потребно да се половина масе почетног радиоактивног узорка распадне, односно постане стабилна. Графички гледано, концепт полувремена је представљен у наставку. Јер је континуирани процес, крива тежи да достигне нула.
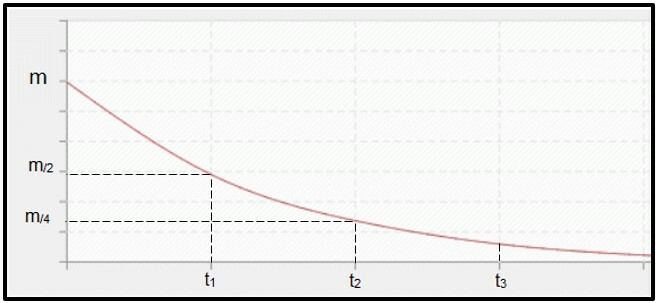
Графикон који представља време полураспада.
Прорачуни који укључују радиоактивни распад следе следеће формуле:
Формула за израчунавање преостале масе након полураспада:
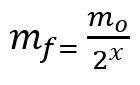
мф - завршна маса
мО. - почетна маса
к - количина протеклих полувремена
Формула за израчунавање времена распадања радиоактивног узорка:
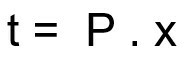
т - време распадања
П - период полураспада
к - количина протеклих полувремена
радиоактивни елементи
Постоје две врсте радиоактивни елементи: ти природни и вештачки. Природни имају елементе који се налазе у природи, већ са својим нестабилним језгрима, попут уранијум, О. актинијум то је радио. Вештачки се производе процесима који дестабилизују језгро атома. У овом случају можемо поменути астатин то је францијума.
Главни радиоактивни елементи су: уранијум-235, кобалт-60, стронцијум-90, радијум-224 и јод-131. Због широке употребе у нуклеарним електранама и лечења карцинома, ови елементи се често појављују у нашем свакодневном животу. Да бисте сазнали више о овој теми, идите на: радиоактивни елементи.
Радиоактивно смеће
Радиоактивни отпад или нуклеарни отпад то је остатак од индустрије који користе радиоактивни материјал у својим процесима који више немају практичну примену. Ово смеће углавном долази из нуклеарне електране то је од медицинске примене.
Велика производња радиоактивног отпада је била еколошки проблем за цео свет, због оскудних и неадекватних услови одлагања и складиштење.
Ова јаловишта су повезана са контаминацијом тла, водених путева и ваздуха, што резултира уништавање животне средине постепено. Поред тога, они такође представљају ризик за људско здравље, као нпр инфекције, карцином а у тежим случајевима контаминације могу довести до смрт.
решене вежбе
(ПУЦ-Цамп-СП) Атомска бомба, која се назива и нуклеарна бомба, има цепиви састојак атома уранијума-235, , алфа емитери честица
, алфа емитери честица 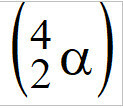 . Сваки атом У-235, када емитује алфа честицу, трансформише се у други елемент, чији је атомски број једнак
. Сваки атом У-235, када емитује алфа честицу, трансформише се у други елемент, чији је атомски број једнак
а) 231.
б) 233.
в) 234.
г) 88.
д) 90.
Шаблон: Када атом емитује алфа честицу, долази до смањења атомског броја за две јединице, према првом закону радиоактивности. Према томе: 92-2 = 90. Слово е.
(ПУЦ-Цамп-СП) Јод-125, радиоактивна врста јода са медицинском применом, има период полураспада 60 дана. Колико грама јода-125 ће остати након шест месеци, на основу узорка који садржи 2,00 г радиоизотопа?
а) 1,50
б) 0,75
в) 0,66
д) 0,25
е) 0.10
Шаблон: Прво се израчунава број полувремена протеклих током 180 дана:
т = П. Икс
180 = 60. Икс
к = 3
Једном када се пронађе број полувремена, израчунава се маса која ће остати на крају 180 дана:
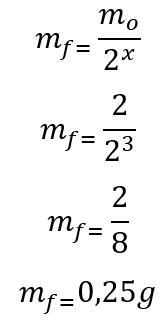
Према томе, 0,25 г радиоизотопа јода-135 остаће на крају шест месеци. Слово Д.
Написао Вицтор Фелик
Дипломирао хемију