Као што је приказано у текстовима "Електромагнетни спектар хемијских елемената" и "Спектар емисије и апсорпције и Кирххофови закони”, Спектри дисконтинуиране емисије сваког хемијског елемента су различити.

Дакле, доле имамо различите спектре неких од ових елемената:

Тако је дански физичар Ниелс Бохр (1885-1962) схватио да то може бити повезано са структуром атома сваког од ових елемената. Због тога је предложио атомски модел који је допунио Рутхерфордов модел, али се фокусирао на понашање електрона око језгра атома.
Нешто раније, Мак Планцк (1858-1947) је предложио теорију да су то електрони квантизовано, у смислу да они емитују и апсорбују одређене количине енергије, као да се ради о малим пакетима енергије, коју је позвао колико (квантни, у једнини).
Тако је Бохр предложио следеће: пошто сваки елемент има другачији спектар, сваки елемент у свом атому има електроне константне и различите енергије од елемента до елемента.
Сваки електрон може остати само у одређеној одређеној орбити, јер у свакој од тих орбита електрон има константну, добро дефинисану и карактеристичну енергију. Електрон може заузимати само нивое енергије за које има одговарајућу енергију.
Спектри су дисконтинуирани јер су електрони квантизовани.
Електрон може променити ниво само ако апсорбује енергију. На пример, када сагоревате натријумову со у Бунсеновом горионику, енергијом доводите електроне. Када апсорбује квант енергије, електрон скаче на други енергетски ниво, задржавајући се у побуђеном стању. Међутим, основно стање је стабилније, па овај електрон емитује апсорбовану енергију и враћа се у своју првобитну орбиту. Ову енергију емитује у облику електромагнетних таласа који се могу визуализовати у облику светлости. У случају натријума, ово светло је интензивно жуте боје. Дакле, када ови таласи прођу кроз призму, добија се дисконтинуирани спектар натријума.
Дакле, за Бохра, свака светлосна линија која се појавила у прекидном спектру елемената указивала је на енергију која се ослобађа када се електрон врати са спољног нивоа на онај ближи језгру.
Доња слика помаже да се боље разуме овај проблем:
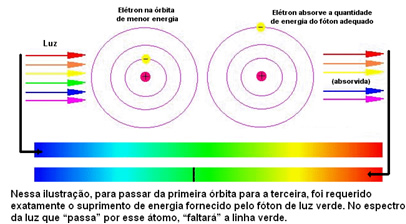
Како су атомима сваког елемента дозвољене само одређене вредности енергије које одговарају енергетским слојевима, за сваки елемент постоји другачији спектар.
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm

