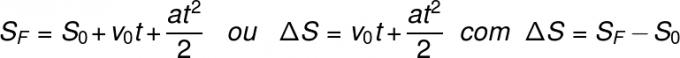Далтонов закон каже да је парцијални притисак сваког гаса у мешавини гаса једнак притиску који би вршио заузимајући запремину смеше, на истој температури. Због тога је укупан притисак мешавине гаса збир парцијалних притисака сваког гаса који га чини.
Размотримо две врсте гасова, А и Б. Сваки од њих заузима исту запремину В и има исту температуру Т. Ако применимо Цлапеиронову једначину на два гаса А и Б, имамо:
П.ТХЕ .В = нТХЕ .Р .Т и стрБ. .В = нБ. .Р .Т
Као што је приказано на горњој слици, ако помешамо два гаса, број молова гасова у смеши (нем) постаје:
нем= нТХЕ+ нБ.
Где:

Али нм = (Пм.В) / Р. Т; па имамо:

Правећи нека поједностављења у горенаведеном изразу, имамо:
П.м= пТХЕ+ стрБ. (Далтонов закон)
Исто размишљање можемо применити на гасове различитих запремина и температура. Погледајмо доњу слику на којој два балона повезана цевчицом занемариве запремине имају контактну славину. Ови балони имају два гаса А и Б, а температуре и запремине се међусобно разликују. Из слике видимо да је славина затворена, према томе:
П.ТХЕ .В = нТХЕ .Р .Т и стрБ. .В = нБ. .Р .Т

Касније, ако отворимо славину, видећемо да се гасови мешају, као што је приказано на илустрацији испод:

За ову смешу имамо следеће односе:
В.м= ВТХЕ+ ВБ.
П.ТХЕ .В = нТХЕ .Р .Т
П.Б. .В = нБ. .Р .Т
Дакле, имамо да се коначни однос ове смеше може проширити на мешавину не гасови. Тако:


Аутор Домитиано Маркуес
Дипломирао физику
Бразилски школски тим