Органска група алкохола је добро позната у органској хемији, карактерише је присуство хидроксила (ОХ) везаног за засићени угљеник. Постоје алкохоли који су незасићени, попут бут-3-ен-1-ол испод:
Х.2Ц ═ ЦХ ─ ЦХ2 ЦХ2 ─ ох
Међутим, нека једињења имају хидроксил директно везан за угљеник са двоструком везом. Ова врста једињења није алкохол, већ припада органској функцији која се назива: енол.
Еноле, према томе, карактерише следећа функционална група:
│
─ Ц ═ ЦХ ─ ох
Номенклатура енола је направљена према следећој шеми:
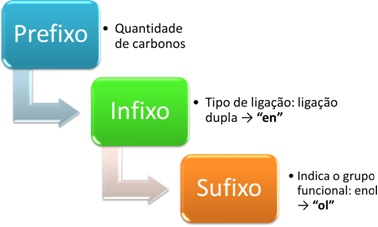
На пример, узмите у обзир следећи једноставнији енол:
Х.2Ц ЦХ ─ ох
Префикс: има 2 угљеника: ет
Инфикс: двострука веза: ен → етилен
Суфикс: енол: Здраво
У случају етанола, није било потребно нумерисати локацију функционалне групе или незасићења, јер није било друге могућности. Али, у доле наведеним случајевима потребно је:
Х.3Ц─ ЦХ═ЦХ ─ ОХ: проп-1-ен-1-ол
Х.3Ц─Ц═ЦХ2: проп-1-ен-2-ол
│
ох
Х.3Ц─ ЦХ═Ц ЦХ2 ЦХ3: пент-2-ен-3-ол
│
ох
Х.3Ц─Ц═ЦХ ЦХ3: бут-2-ен-2-ол
│
ох
Еноли су врло нестабилна једињења, јер могу проћи кроз врсту динамичке изомерије која се назива таутомерија, у којој изомери коегзистирају у динамичкој равнотежи у истој течној фази.
Кисеоник у енолу је веома електронегативан, што привлачи електроне из двоструке везе угљеника, што је слаба веза коју је лако заменити, формирајући алдехид или кетон.
На пример, у раствору сирћетног алдехида (етанал), мали део се трансформише у етанол, који заузврат регенерише назад у алдехид. Дакле, постоји хемијска равнотежа између ових једињења која имају исту молекулску формулу Ц.2Х.4О:
Етанал Етанол
ох
║ │
Х.3Ц - Ц - Х. ↔ Х.2Ц ═ Ц - Х.
енол алдехид
Још један енол, проп-1-ен-2-ол, може да уђе у динамичку равнотежу са кетоном, пропаноном:
Пропаноне Проп-1-ен-2-ол
ОХ ОХ
║ │ │
Х.3Ц - Ц - Ц - Х ↔ Х2Ц ═ Ц - ЦХ2
енол кетон
За више детаља прочитајте текст: Динамичка уставна изомерија или таутомерија.
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/enois-sua-nomenclatura.htm

