O pH raztopine označuje vsebnost (merjenje) hidronijevih ionov (H3O+) prisoten v sredini. Ta vsebina določa, ali ima analizirana raztopina kisel, bazičen ali nevtralen značaj.
Opazovanje: Omeniti velja, da je vsebnost hidronija (H3O+ ali H+) lahko preprosto pridobite v laboratoriju s pomočjo indikatorskih trakov pH - ki pa nimajo velike natančnosti v merilu - ali z opremo, imenovano peagometer, ki ima ravno natančnost pri merjenju pH rešitev.
Pedometer ali potenciometer za merjenje pH raztopine
Za izvedbo izračuni, ki vključujejo pH rešitve lahko uporabimo naslednjo logaritemsko enačbo:
pH = - log [H3O+]
ali
pH = - log [H+]
POMEMBNO: Pri izračunih, ki vključujejo pH raztopine, vedno uporabimo osnovni 10 logaritem.
Mind Map: Izračun PH rešitev

* Če želite prenesti miselni zemljevid v PDF, Klikni tukaj!
Iz zgornje logaritemske enačbe lahko še vedno uporabimo naslednjo poenostavitev (dobljeno z uporabo logaritemske funkcije) te enačbe:
[H3O+] = 10-pH
Opazovanje: Zgornji poenostavljeni izraz lahko uporabimo le, če je vrednost pH celo število; v nasprotnem primeru je treba uporabiti logaritemsko funkcijo.
Pomembno je poudariti, da so izračuni, ki vključujejo pH raztopine, vedno povezani s pOH (hidroksilni potencial / OH-), saj obe moči temeljita na samoionizaciji vode (Kw = 10-14, pojav, pri katerem voda proizvaja toliko H+ koliko oh-) in Ostwaldovega zakona redčenja (bolj kot je razredčena raztopina, večja je količina H kationov+ ). Tako:
približno avtoionizacija vode:
Kw = [H+]. [oh-], torej pH + pOH = 14
zakon iz Ostwaldova razredčitev(Preko njega lahko vemo, koliko se določen material ionizira ali disociira v vodi):
Kjaz = M.α2
Ki = konstanta ionizacije snovi v vodnem mediju;
M = molarnost ali molska koncentracija snovi v vodnem mediju;
α2 = stopnja ionizacije ali disociacije materiala v mediju.
Razvrstitev raztopine kot kisle, bazične ali nevtralne bo imela naslednja merila (a 25 OÇ):
-
eno rešitev bo nevtralna ko je koncentracija H+ je enaka koncentraciji OH- ali imajo pH enak 7.
Ne ustavi se zdaj... Po oglaševanju je še več;)
[H+] = [OH-]
eno raztopina bo kisla ko je koncentracija H+ je večja od koncentracije OH- ali je pH med 0 in 7.
[H+]> [OH-]
eno rešitev bo osnovna ko je koncentracija H+ je manjša od koncentracije OH- ali je pH med 7 in 14.
[H+] -]
Oglejte si nekaj primerov izračunov, ki vključujejo pH raztopin:
1º)Če vemo, da je koncentracija hidronija v kavi enaka 1,10-5, kakšen bo pH v tej raztopini?
kako telovaditi koncentracijo hidronija za kavo lahko uporabite poenostavljeno formulo pH:
[H3O+] = 10-pH
1.10-5 = 10-pH
10-5 = 10-pH
-5 = -pH
pH = 5
Ker je pH manjši od 7, je raztopina kisla.
2º) (UFU) Kolikšen je pH 0,045 mol / L raztopine ocetne kisline, ob predpostavki, da je Kjaz = 1,.10-5? Podatki: log 2 = 0,3; log 3 = 0,48.
Podatki o vadbi:
M = 0,045 mol / l
Kjaz = 1,8.10-5
log 2 = 0,3
log 3 = 0,48
Kako je vaja zagotovila molarnost (M) in ionizacijska konstanta (Kjaz),najprej določimo stopnjo ionizacije omenjene kisline, ker je koncentracija hidronija (H3O+ ali H+) je vedno rezultat množenja med molarnostjo in stopnjo ionizacije. Kmalu:
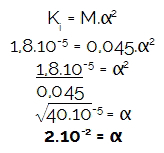
Nato izračunajmo količina pomnoževalne molarnosti hidronija kisline glede na stopnjo ionizacije:
[H3O+] = M.α
[H3O+] = 0,045.2.10-2
[H3O+] = 0,09.10-4
[H3O+] = 9.10-4 mol / L
Končno smo postavili vrednost koncentracije hidronija v logaritemski enačbi pH:
pH = - log [H3O+]
pH = - log 9.10-4
pH = 4 - log 9
pH = 4-log 32
pH = 4 - 2. (dnevnik 3)
pH = 4- (2.0.48)
pH = 4-0,96
pH = 3,04
Ker je pH manjši od 7, je raztopina kisla.
3º)(Cefet-PR) A 45 OC, Kw nevtralne raztopine je enaka 4,10-4. Kakšna je torej vrednost pH te raztopine pri tej temperaturi? Podatki dnevnika 2 = 0,3.
Kako vaja pove, da je rešitev nevtralno, kmalu [H3O+] je enako [OH-]:

Končno smo postavili vrednost koncentracije hidronija v logaritemski enačbi pH:
pH = - log [H+]
pH = - log 2.10-7
pH = 7 - log 2
pH = 7-0,3
pH = 6,7
Ker je pH skoraj 7, je raztopina nevtralna (kot je navedeno v izjavi o vadbi), ker je temperatura 45 OÇ.
Jaz, Diogo Lopes Dias
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Izračuni, ki vključujejo pH raztopin"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/calculos-envolvendo-ph-solucoes.htm. Dostopno 28. junija 2021.
Ostwaldov zakon, ionizacijska konstanta, molska koncentracija, stopnja ionizacije, šibek elektrolit, število mol ioniziranih, Friedrich Wilhelm Ostwald, monokisline, monobaze.

