Srednješolci so vedno izpostavljeni soočanju redoks reakcije s ioni, tako na sprejemnih izpitih kot na državnem srednješolskem izpitu (Enem). Tako je uravnoteženje teh enačb lahko zelo grozljiv predmet.
Da bi olajšali razumevanje te teme, skuša to besedilo obravnavati uravnoteženje redoks enačb z ioni z opisom nekaterih korakov za njegovo izvedbo. Za to moramo najprej ugotoviti to vrsto kemične reakcije.
Ob redoks reakcije z ioni se prepoznajo po prisotnosti ene ali več komponent z naboji (pozitivnimi ali negativnimi), to je ioni (kationi ali anioni), ki so lahko prisotni v reagentih ali produktih, kot v obeh primerih a sledite:
1. primer:Cr2O72- + Fe2+ + H+ → Cr3+ + Fe3+ + H2O
2. primer:Kl2 + C + H2O → CO2 + H+ + Kl-
Za izvedbo uravnoteženje enačb redoks reakcij z ioni, nujno je slediti nekaterim korakom, kot so:
1. korak: določite NOX vsakega od atomov reaktantov in produktov enačbe;
2. korak: preverite, katere vrste so trpele oksidacija;
3. korak: določite variacijo NOX vrsta, ki je bila podvržena oksidaciji;
4. korak: variacijo, ugotovljeno v tretji stopnji, pomnožimo s številom atomov oksidirajočih vrst;
5. korak: preverite, katere vrste so trpele zmanjšanje;
6. korak: določite različico NOX vrste, ki se je zmanjšala;
7. korak: pomnožite variacije, ugotovljene v tretjem koraku, s številom atomov vrste, ki jo zmanjša;
8. korak: uporabite vrednost, ugotovljeno v četrtem koraku, kot koeficient vrste, ki se zmanjša;
9. korak: uporabite vrednost, ugotovljeno v sedmem koraku, kot koeficient oksidirajočih vrst;
10. korak: dajte koeficiente v druge vrste po metodi poskusno uravnoteženje. Pri tistih vrstah, kjer tega ni mogoče, kot koeficiente dajte neznanke;
11. korak: pomnožite koeficient vsake vrste z njeno obremenitvijo;
12. korak: vsoto nabojev reaktantov izenačimo s seštevkom izdelkov, da poiščemo koeficient ene od vrst z neznankami;
13. korak: dokončajte ravnotežje s poskusno metodo.
Da bi olajšali razumevanje, sledite korakom, opisanim zgoraj, v naslednjem primeru a redoks enačba z ioni:

Ionska enačba, ki prikazuje nekatere ione in splošne skupine nabojev 0
1. korak: NOX vsakega atoma.

NOX atomov, prisotnih v enačbi
2. korak: Vrste, ki so podvržene oksidaciji.

Vrste, ki so podvržene oksidaciji v enačbi
Ker se NOX joda poveča od -1 do 0 od reaktanta do produkta, je vrsta, ki je podvržena oksidaciji.
3. korak: Določite NOX variacije oksidiranih vrst.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Če želite to narediti, samo odštejte največji NOX z najnižjim NOX:
∆NOX = (0) – (-1)
∆ NOX = 0 + 1
∆ NOX = 1
4. korak: Množenje NOX s količino.
V tem koraku pomnožimo variacijo, ugotovljeno v tretjem koraku, s številom atomov vrste.
jaz- = ∆NOX.1
jaz- = 1.1
jaz- = 1
5. korak: Vrste, pri katerih se zmanjša.

Vrste, ki trpijo zaradi enačbe
Ker se NOx kroma zmanjša iz +7 na +3 iz reaktanta v proizvod, je vrsta reducirana.
6. korak: Določite različico NOX zmanjšane vrste.
Če želite to narediti, samo odštejte največji NOX z najnižjim NOX:
∆NOX = (+6) – (+3)
∆ NOX = +6 – 3
∆ NOX = 3
7. korak: Množenje NOX s količino.
V tem koraku pomnožimo variacije, ugotovljene v šestem koraku, s številom atomov vrste.
Cr2O72- = ∆NOX.1
Cr2O72- = 3.2
Cr2O72- = 6
8. korak: Začnite uravnotežiti.
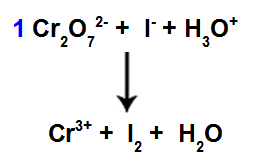
Začetek uravnoteženja z uporabo najdenega koeficienta
V tem koraku začnemo z uravnoteženjem tako, da koeficient, ki ga najdemo v četrtem koraku, pri vrstah, ki so utrpele zmanjšanje.
9. korak: Nadaljujte z uravnoteženjem.

Nadaljevanje uravnoteženja z uporabo najdenega koeficienta
10. korak: Uporabite preskusno metodo.
V reaktantu je 6 atomov I, zato moramo v vrsto I vnesti koeficient 32 izdelka, ker sta v njem samo 2 atoma Cl;
Kot pri vrstah 1, Cr2O72-, obstajata 2 Cr atoma, pri vrstah Cr moramo dati koeficient 23+ izdelka.
Ker imamo kisik pri treh vrstah in pri dveh ni koeficientov, moramo za nadaljevanje ravnotežja v preostale vrste postaviti neznanke:
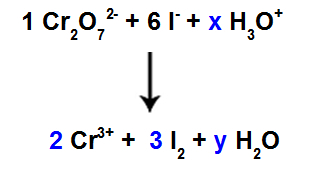
Koeficienti po uporabi preskusne metode
11. korak: Množenje vsake vrste z njeno obremenitvijo.
Če želite to narediti, samo pomnožite koeficient vrste z njeno obremenitvijo, kot sledi:
V reagentih:
Cr2O72- = 1.(-2) = -2
jaz- = 6.(-1) = -6
H3O+ = x. (+ 1) = + x
Na izdelkih:
Cr3+ = 2.(+3) = +6
jaz2 = 4.0 = 0
H2O = y.0 = 0
12. korak: Vsota stroškov.
V tem koraku moramo dodati veliko reagentov in izdelkov, najdenih v koraku 11:
Reagenti = izdelki
-2 + (-8) + (+ x) = +6 + 0 + 0
-2 - 6 + x = 6
-8 + x = 6
x = 6 + 8
x = 14
13. korak: Konec uravnoteženja.
Za dokončanje izravnave moramo:
Rezultat najdemo v 12. koraku pri vrsti H3O+;
Ker imamo zdaj v reagentu 42 atomov H, je treba v vrsto H postaviti koeficient 212V izdelku.
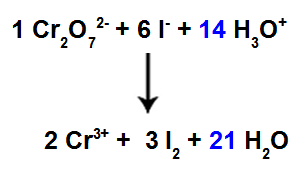
Enačba uravnotežene ionske reakcije
Jaz, Diogo Lopes Dias
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Rdeče-redukcijske reakcije z ioni"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao-com-ions.htm. Dostopno 28. junija 2021.