Ena mešanje raztopin iste topljene snovi brez kemične reakcije sestoji iz združevanja v isti posodi dveh raztopin, na primer s kalijevim kloridom (Kcl). V tej vrsti zmesi nikoli ne bo prišlo do kemične reakcije zaradi prisotnosti enakih topljenih snovi, to pomeni, da imata oba enak kation in enak anion. Tako lahko rečemo, da ko izvajamo mešanico s temi lastnostmi, dodajamo samo količino topljene snovi in topila, ki sestavljata obe raztopini.
Če na primer raztopino 1L vode in 4 gramov KI (kalijevega jodida) zmešamo z drugo raztopino 2L vode in 6 gramov KI, bomo dobili novo raztopino 3L vode in 10 gramov KI .
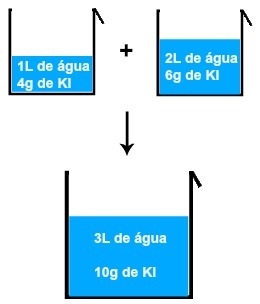
Rezultat mešanja dveh raztopin kalijevega jodida
Z analizo slike lahko ugotovimo, da masa topljene snovi (m1') prve raztopine dodamo masi topljene snovi (m1'') druge rešitve, kar ima za posledico maso topljene snovi (mF) v končni rešitvi (Mix):
m1'+ m1'' = mF
V primeru:
4 + 6 = 10 gramov
Enako se zgodi s količino vode, ki je prisotna v vsaki raztopini, to pomeni, da količina prve (V '), dodane prostornini druge (V' '), povzroči končno prostornino (V'F):
V '+ V' = VF
V primeru:
1 + 2 = 3 L
Ker ima vsaka raztopina nekaj raztopljene topljene snovi, imamo tukaj mešanico raztopin iste topljene snovi, potem lahko iz zgoraj navedenega določimo koncentracijo (skupna, molarnost) vsake mešane raztopine in tudi končne raztopine.
Zato si moramo zapomniti formule za izračun teh koncentracij:
Skupna koncentracija:
C = m1
V
m1 = masa raztopljene raztopine
V = prostornina raztopine
OPOMBA: izoliranje m1 v formuli imamo: m1 = Življenjepis
Molarnost:
M = m1
M1.V
M1 = molska masa topljene snovi.
OPOMBA: izoliranje m1 v formuli imamo: m1 = M.M.1.V
Ker mešanica raztopin iste raztopljene snovi naslavlja vsoto mase raztopljene raztopine, lahko vsa opažanja nadomestimo v naslednjem izrazu:
m1'+ m1'' = mF
C'.V '+ C' '. V' = CF.VF
Ne ustavi se zdaj... Po oglaševanju je še več;)
C '= skupna koncentracija raztopine 1
C '= skupna koncentracija raztopine 2
Če izračun zmesi raztopin vključuje molarnost:
m1'+ m1'' = mF
M'.V '+ M' '. V' = MF.VF
OPOMBA: Ker je topljeno sredstvo enako, je molska masa v vsaki od raztopin enaka; zato je pri izračunu zanemarjen.
zdaj glej primeri, ki zajemajo izračune v mešanici raztopin iste raztopljene snovi brez kemijske reakcije:
Primer 1: (Mackenzie-SP-Adaptada) Če dodamo 600 ml raztopine 14 g / L KOH določenemu volumnu (v) 84 g / L raztopine iste baze, dobimo 67,2 g / L raztopine. Količina (v) dodane raztopine 84 g / L je:
a) 0100 ml
b) 3000 ml
c) 2700 ml
d) 1500 ml
e) 1900 ml
Podatki, pridobljeni z vajo, so bili:
V '= 600 ml
C '= 14 g / L
V "=?
C "= 84 g / l
VF = ?
CF = 67,2 g / l
Pred določitvijo dodane prostornine raztopine 1 moramo na začetku določiti končni volumen z naslednjim izrazom:
V '+ V' = VF
600 + V "= VF
Če nadomestimo vrednosti, podane v matematičnem izrazu spodaj, imamo:
C'.V '+ C' '. V' = CF.VF
14. 600 + 84 V "= 67,2. (600 + V")
8400 + 84.V "= 67,2. 600 + 67,2 V
8400 + 84.V "= 40320 + 67.2.V"
84.V "- 67.2.V" = 40320 - 8400
16.8.V "= 31920
V "= 31920
16,8
V "= 1900 ml
2. primer: (UFOP) V 1000 ml merilno bučko dodamo 250 ml 2 M raztopine žveplove kisline s 300 ml 1 M raztopine iste kisline in prostornino dopolnimo z destilirano vodo do 1000 ml. Določite molarnost nastale raztopine.
Podatki, pridobljeni z vajo, so bili:
V '= 250 ml
M '= 2 M
V "= 300 ml
M "= 1 M
VF = 1000 ml
MF = ?
Če želite določiti molarnost končne rešitve, uporabite matematični izraz, ki predstavlja postopek:
M'.V '+ M' '. V' = MF.VF
2. 250 + 1. 300 = MF.1000
500 + 300 = MF. 1000
800 = MF
1000
MF = 0,8 mol / l
Jaz, Diogo Lopes Dias
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Zmes raztopin iste topljene snovi brez kemične reakcije"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/mistura-solucoes-mesmo-soluto-sem-reacao-quimica.htm. Dostop 27. junija 2021.