THE entalpija tvorbe, imenovano tudi standardna entalpija tvorbe, ali standardna toplota tvorbe, je izračun toplote, ki se sprosti ali absorbira pri tvorbi 1 mola snovi iz preprostih snovi v standardnem stanju.
Absolutne vrednosti entalpij posamezne snovi ni mogoče izračunati, lahko pa s pomočjo kalorimetra izračunamo variacijo entalpije, ki se pojavi v reakciji.
Tega si je treba zapomniti dogovorjeno je bilo, da se za enostavne snovi v standardnem stanju sprejme entalpija, enaka nič. Če želimo torej ugotoviti, kakšna je entalpija tvorbe snovi, moramo iz preprostih snovi vedeti samo vrednost entalpije njene tvorbene reakcije.
Na primer, želimo najti entalpijo 18 gramov vode, kar ustreza 1 molu, saj je njegova molska masa 18 g / mol. Za to najprej potrebujemo reakcijo za tvorjenje vode iz preprostih snovi, kot je prikazano spodaj:
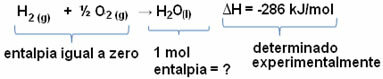
Upoštevajte, da je bila vrednost spremembe entalpije, ki se je zgodila v tej reakciji, eksperimentalno določena s kalorimetrom in je enaka -286 kJ / mol.
Formula, ki izračuna to spremembo entalpije (ΔH), je:
ΔH = HIzdelki - HReagenti
Ker torej že vemo vrednost ΔH in da je entalpija reaktantov enaka nič (ker so v običajnem stanju preproste snovi), lahko potem sklepamo da je vrednost entalpije 1 mol vode enaka spremembi entalpije tvorbene reakcije, saj je edini produkt te reakcije, kot je prikazano spodaj:
ΔH = HIzdelki - HReagenti
-286 kJ / mol = HH2O - (HH2 + H1/2 O2)
-286 kJ / mol = HH2O - 0
HH2O = - 286 kJ / mol
Ne ustavi se zdaj... Po oglaševanju je še več;)
Ta vrsta entalpije, dosežena z entalpijo enostavnih snovi v standardnem stanju, je torej standardna entalpija tvorbe (ΔH0).
Zdaj obstaja veliko snovi, ki ne nastanejo neposredno z eno samo reakcijo, na primer voda. V takih primerih lahko entalpijo tvorbe izračunamo iz spremembe entalpije reakcije.
Na primer NH4Cl nastane z naslednjo reakcijo:
NH3 + HCl → NH4Kl ΔH = -176 kJ / mol
Upoštevajte, da noben od reaktantov ni preprosta snov, zato jim ne moremo določiti entalpije nič. Vedeti moramo entalpije tvorbe vsakega reagenta, saj te nastanejo z reakcijami med preprostimi snovmi:
NH3: ΔH = -46 kJ / mol
HCl: ΔH = -92,4 kJ / mol
Če seštejemo ti dve entalpiji, dobimo vrednost entalpije reaktantov in lahko najdemo entalpijo NH4Cl:
HR = HNH3 + HHCl
HR = (-46 + (-92,4) kJ / mol)
HR = -138,4 kJ / mol
V formuli nadomestimo:
ΔH = HIzdelki - HReagenti
-176 = HNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314,4 kJ / mol
V tem primeru smo neposredno sešteli vrednosti entalpij tvorbe reaktanta, ker je bilo reakcijsko razmerje le 1 mol. Če pa je v drugih reakcijah količina molov drugačna, bo najprej treba entalpijo tvorbe reaktanta pomnožiti s številom molov.
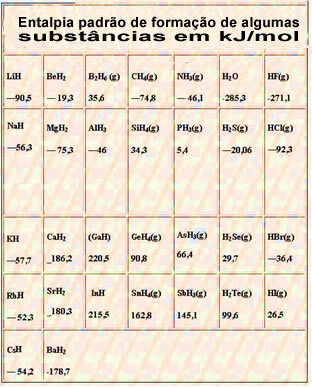
Spodaj je tabela s standardno entalpijo tvorbe nekaterih snovi pri 25 ° C in 1 atm:
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Entalpija tvorbe"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm. Dostop 27. junija 2021.
