Osnova je anorganska snov ki je po mnenju švedskega kemika Svante Arrhenius, če ga damo v vodo, trpi pojav ionska disocijacija, v katerem je izdana različica ioni: kation (Y+) in hidroksid anion (OH-).

Splošna formula Arreniusove osnove
skupina Y a osnova lahko je katera koli kovina ali drugače iz amonijeve skupine (NH4+), ki se med disociacijo sprostijo v vodi kot kationi, kot lahko vidimo v enačbi, ki predstavlja postopek:
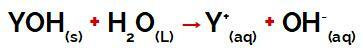
Enačba, ki predstavlja disociacijo baze
Spodaj glej nekaj zelo pomembnih informacij v zvezi s klasifikacijo in nomenklaturo baze.
1) Razvrstitev glede na topnost baz(zmožnost da da se raztopi v vodi)
Baze topen: imeti v sestavi alkalijsko kovino ali amonij;
Baze težko topen: imajo zemeljskoalkalijska kovina v sestavi. Primer: magnezijev hidroksid, ki se pogosto uporablja kot antacid in odvajalo;
baze praktično nerešljiv: imeti v sestavi katero koli drugo kovino. Primer: aluminijev hidroksid, ki se pogosto uporablja kot antacid.
2) Razvrstitev glede na množična moč(zmožnost da ločiti v vodi)
Baze močna: imajo v sestavi alkalijske ali zemeljskoalkalijske kovine, razen magnezija;
Baze šibka: imeti v sestavi katero koli drugo kovino.
3) Osnovna nomenklatura
Če želite poimenovati osnovo, sledite spodnjemu pravilu poimenovanja:
Hidroksid + de + ime kovine ali amonija
Primer: Ca (OH)2 → kalcijev hidroksid
Če ima osnova kemični element, ki ne spada v družine IA, IIA ali IIIA (in to ni srebro ali cink), moramo pred imenom elementa z rimskimi številkami navesti število hidroksili:
Primer: Ti (OH)4 → titanov hidroksid IV
Jaz, Diogo Lopes
Vir: Brazilska šola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm

