Hibridizacija je ime za fuzijo ali združitev nepopolnih atomskih orbitalov, pojav, ki povečuje število kovalentne vezi kar lahko naredi atom. Spomnimo se, da je orbita območje atoma, kjer je večja verjetnost, da bomo našli elektron.
Poznati število vezi, ki jih atom ustvari, in razumeti pojav hibridizacija, treba je vedeti nekaj temeljnih točk o atomu:
1O točka: energijski podravni
Podniva energije, ki jih ima lahko atom, so s, p, d, f.
2O točka: število orbital na podnivo
Vsak podnivo energije ima različno količino orbital, kot lahko vidimo spodaj:
Podnivo s: 1 orbitala;
p podnivo: 3 orbitale;
Podnivo d: 5 orbital.
Splošna predstavitev teh orbital je narejena na naslednji način:
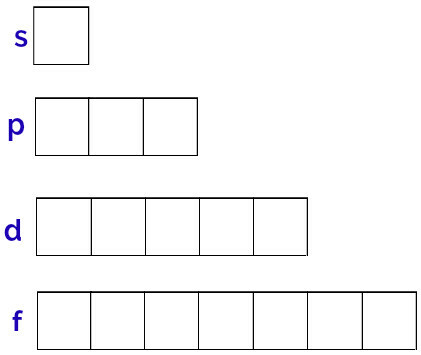
Prikaz orbital vsakega podniva
Po Pauliju ima lahko orbitala največ 2 elektrona, s vrti (vrtljivi gibi) nasproti.
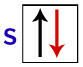
Prikaz s-orbite z njenimi elektroni
Po Hundu naj bi orbita podniva dobila svoj drugi elektron šele, ko so vse druge orbitale tega podniva že prejele prvi elektron.
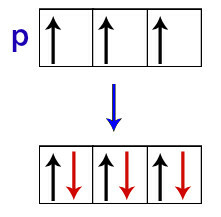
Porazdelitev elektronov v p podravni
3O točka: elektronska distribucija
Za razumevanje hibridizacije in števila vezi, ki jih ustvari atom, je nujno izvesti elektronska distribucija na diagramu Linusa Paulinga.

Diagram Linusa Paulinga
Spomnimo se, da je največje število elektronov v posameznem podnivu:
s = 2 elektrona;
p = 6 elektronov;
d = 10 elektronov;
f = 14 elektronov.
Po tem kratkem pregledu lahko zdaj določimo kaj je hibridizacija. Za to bomo uporabili kemični element bor (atomsko število = 5) kot primer.
Ko izvajamo elektronsko distribucijo bora, imamo:
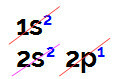
Elektronska porazdelitev bora v diagramu Linus Pauling
Pri tej porazdelitvi je mogoče opaziti, da ima bor 2 elektrona v podnivu in 1 elektron v podnivu valentna plast.
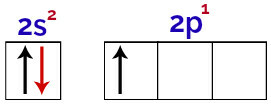
Elektroni v orbitalah borove valentne plasti
Ker ima bor 1 nepopolno orbitalo, bi moral torej narediti samo eno kovalentno vez, saj je število vezi vedno neposredno povezano s številom nepopolnih orbital.
Ko borov atom prejme energijo iz zunanjega okolja, se njegovi elektroni, zlasti tisti v valentni lupini, vzbudijo. To povzroči, da eden od elektronov s s-orbitale zapusti in zasede eno od praznih p-orbitalov, kar ima za posledico 3 nepopolne atomske orbitale, kot lahko vidite na naslednji sliki:

Prikaz vzbujenega stanja atoma bora
Na koncu obstaja še združitev nepopolne orbitale z nepopolnimi p orbitalami. Ta zveza se imenuje hibridizacija. Ker imamo fuzijo s orbitale z dvema p, se imenuje hibridizacija sp2.
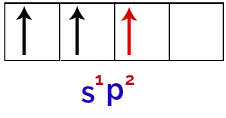
Predstavitev hibridiziranih orbital v borovem atomu
Poleg bora se v hibridizaciji pojavlja tudi več drugih kemičnih elementov, kot so žveplo (S), ksenon (Xe), fosfor (P), ogljik (Ç), berilij (Bodi).
Jaz, Diogo Lopes Dias
Vir: Brazilska šola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-hibridizacao.htm


