Analiza fizikalnih in kemijskih lastnosti spojin, ki izvajajo kovalentne vezi (z izmenjavo elektronov), nam pokaže, da obstajajo velike razlike med temi materiali. Preden pa si ogledamo te značilnosti, poglejmo, kakšna je razlika med molekularnimi in kovalentnimi snovmi.
Ob molekularne snovi so tiste, ki nastanejo, ko so atomi povezani s kovalentnimi vezmi, pri čemer nastanejo molekule določenega števila.
Vendar pa lahko iz kovalentne vezi izvirajo tudi spojine v mrežni strukturi z zelo velikim in nedoločenim številom atomov, ki so makromolekule. Takšne snovi se imenujejo kovalentne spojine ali trdne snovi kovalentne mreže. Nekateri primeri teh spojin so: diamant (C), grafit (C), silicijev dioksid (SiO2) in silicijevega karbida (SiC).
Zdaj pa si poglejmo njegove glavne lastnosti:
- Fizično stanje pri sobni temperaturi: V okoljskih pogojih najdemo molekularne in kovalentne spojine v treh fizikalnih stanjih (trdna, tekoča in plinska).
Primeri:
O Trdno: sladkor (saharoza), kremen (pesek), diamant, grafit;
O Tekočina: voda, aceton, etanol;
O Plinast: Vodikov sulfid, klorov plin, bromov plin, vodikov plin.

- Tališče in vrelišče: Na splošno so tališča in vrelišča teh snovi manjši od ionskih snovi.
Kovalentne snovi imajo višje temperature vrelišča kot molekularne, vedno nad 1000 ° C. Ker so njihove molekule tesneje povezane in tvorijo kristalne rešetke, je treba zagotoviti več energije, da bodo spremenile svoje stanje.
Na vrelišče in tališče kovalentnih in molekularnih spojin vplivata dva dejavnika: a molska masa in medmolekularna sila.
Večja kot je molska masa, večja je vztrajnost molekule in posledično višje vrelišče in tališče. Če se molarne mase približajo, pogledamo medmolekularne sile. Najbolj intenzivna medmolekularna sila je vodikova vez, ki vodi do višjega vrelišča in tališča. Vmesni je stalni dipol in najšibkejši, ki vodi do nižjega vrelišča in tališča, je inducirani dipol.
- Električni tok: V svoji čisti obliki tako tekočine kot trdne snovi ne prevajajo električnega toka.
Izjema je grafit, ki prevaja električni tok v trdni obliki, ker njegovi elektroni z dvojno vezjo odzvanjajo in imajo zato določeno gibljivost.
- Topnost: Polarji se raztopijo v polare, nepolari pa v nepolare.
- Vztrajnost: Odpornost kovalentnih snovi na udarce ali mehanske udare je majhna. Na splošno so to krhke trdne snovi, kot je prikazano v primeru stekla, ki ga tvorijo natrijev in kalcijev silikat.

- Žilavost: Na splošno imajo visoko trdoto. Z izjemo grafita, ker so njegovi atomi ogljika povezani s tremi drugimi atomi ogljika, tvorijo šesterokotne plošče z določeno gibljivostjo, zaradi česar je mehak. Zaradi tega se uporablja celo kot mazivo.
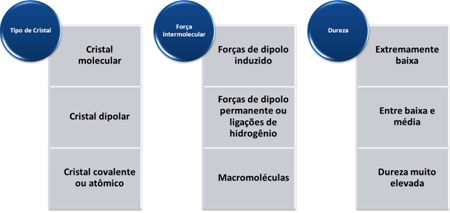
Trdota teh snovi se razlikuje glede na vrsto kristala, kot prikazuje spodnja tabela:
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/propriedades-dos-compostos-covalentes-moleculares.htm

