Kot že ime pove, med ioni pride do ionske vezi. Ker imajo nasprotne naboje, se kationi (element s pozitivnim nabojem) in anioni (element z negativnim nabojem) elektrostatično privlačijo in tvorijo vez. Vendar ionsko trdno snov sestavlja aglomerat kationov in anionov, organiziranih z dobro določenimi geometrijskimi oblikami, imenovanimi rešetke ali kristalne rešetke.
Na primer, sol (natrijev klorid) nastane z dokončnim prenosom elektrona iz natrija v klor, kar povzroči nastanek natrijevega kationa (Na+) in kloridni anion (Cl-). V praksi ta reakcija ne vključuje le dveh atomov, temveč ogromno in nedoločeno število atomov, ki tvorijo kristalno mrežo v obliki kubika, kot je prikazano spodaj:

Če kristale soli pogledamo z optičnim elektronskim mikroskopom, bomo videli, da so zaradi svoje notranje strukture dejansko kubični.

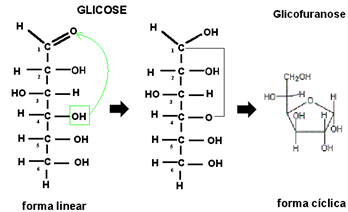
Ker je vsaka ionska spojina nato sestavljena iz nedoločenega in zelo velikega števila ionov, kako lahko predstavljamo ionsko spojino?
Običajno se uporablja formula formula enote
, ki je tisti, ki predstavlja delež, izražen z najmanjšim možnim številom kationov in anionov, ki tvorijo kristalno mrežo, tako da se celotni naboj spojine nevtralizira. Da bi se to zgodilo, je potrebno, da je število elektronov, ki se jim daje atom, enako številu elektronov, ki jih prejme drugi atom.Pomembni so nekateri vidiki enotne formule ionskih spojin, glejte nekatere:
- Vedno najprej napiši kation in nato še anion;
- Ker je vsaka ionska spojina električno nevtralna, posameznih ionskih nabojev ni treba zapisovati;
- Številke indeksa, ki se pojavijo na desni strani vsakega iona, kažejo razmerje med atomi kationa in anionom. Te številke se imenujejo indeksi in številka 1 ni zapisana.
Na primer, v primeru natrijevega klorida imamo, da je njegova enota formula NaCl, saj imamo natančno 1 natrijev kation za vsak kloridni anion.
Glej še en primer, Al3+ ima tri pozitivne naboje, medtem ko ima F- ima le enega negativnega, zato so za nevtralizacijo spojine potrebni trije fluoridni anioni. Tako sklepamo, da je njegova enota formula AlF3.
Enostaven način, da pridemo do formule enote ionske spojine, je zamenjava njenih nabojev za njene indekse, kot je prikazano spodaj spodaj:

Primeri:

Druga formula, ki se uporablja za predstavitev ionskih snovi, je Lewisova formula ali elektronska formula, kaj predstavlja elektrone iz valentne lupine ionov "kroglic" okoli simbola elementa. V primeru soli imamo:

Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm