Organske spojine je mogoče predstaviti na različne načine, kot so ravna strukturna formula, poenostavljena ali zgoščena strukturna formula ali formula pomišljaja. Vendar pa je najenostavnejša predstavitev preko molekularne formule.

Tako poglejmo, kako določiti molekulsko formulo organskih spojin na podlagi drugih zgoraj omenjenih formul.
1. Preko ploske strukturne formule:ta formula prikazuje razporeditev ali razporeditev atomov znotraj molekule. Spodaj je na primer ravna strukturna formula enega od ogljikovodikov, prisotnih v bencinu.

Upoštevajte, da so v tej formuli prikazani vsi atomi in vse obstoječe vezi med njimi. zdaj, da določite molekulsko formulo te spojine, samo preštejte število atomov vsakega elementa in postavite indeks na spodnjo desno stran zadevnega elementa.
Pomemben vidik, ki ga je treba poudariti, je ta molekulsko formulo organskih spojin vedno začnemo iz elementa ogljik, saj je glavna sestavina teh snovi. Glej primer:
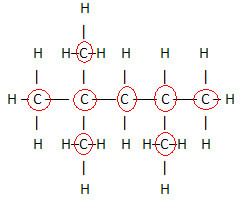
Ker je ogljikov 8, začnemo pisati molekulsko formulo takole: Ç8
Za dokončanje te formule preštejemo količino vodika:
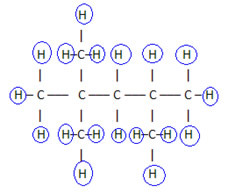
torej tvoj molekularna formula é Ç8H18.
2. Preko poenostavljene ali zgoščene strukturne formule: v tej vrsti formule je količina vodika skrajšana. Oglejte si na primer isto formulo za molekulo, ki jo najdemo v bencinu, zdaj v kondenzirani obliki:
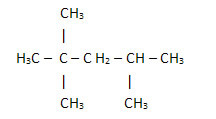
Tako je še lažje prešteti količino vodika, le seštejte indekse (3 +3+ 3 +2 +1 +3 +3 = 18).
Zdaj pa poglejmo zgoščeno strukturno formulo linolne kisline, ki obstaja v zelenjavi, kot so bombaž, soja, sončnice itd. in ki se uporablja v barvah in lakih:
H3C─CH2CH2CH2CH2CH═CH─CH2CH═CH─CH2CH2CH2CH2CH2CH2CH2─COOH
Če preštejemo količino ogljika, vodika in kisika, imamo naslednje molekularna formula linolne kisline: Ç18H32O2.
3. Skozi formulo udarca: ta formula dodatno poenostavi predstavitev organskih spojin, saj izpušča skupine C, CH, CH2 in CH3.
Primer je linolna molekula, poglejte, kako izgleda:

Najprej preštejmo količino ogljika, pri čemer se spomnimo, da je v tej formuli vsaka vez med ogljiki predstavljena s pomišljajem. Tako konice, kot tudi dve pregibni točki, ustrezajo ogljikovim atomom.
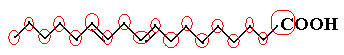
Torej imamo: Ç18
Zdaj, da preštejemo količino vodika, se moramo spomniti, da so vezi med ogljiki in vodiki implicirane, saj je znano, da ogljik tvori štiri vezi; tako je količina manjkajočih vezi količina vodika, vezanega na ta element.
Oglejte si spodnja pojasnila:
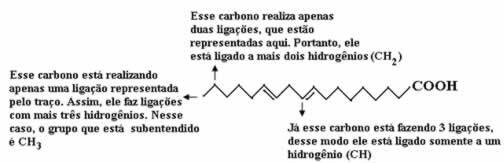
Tako bo količina vodika: 32.

Količino kisika je precej enostavno prešteti, saj sta le dva. Odkar molekularna formula é: Ç18H32O2.
Avtor: Jennifer Fogaça
Diplomirala iz kemije
vir: brazilska šola - https://brasilescola.uol.com.br/quimica/formulas-moleculares-compostos-organicos.htm
