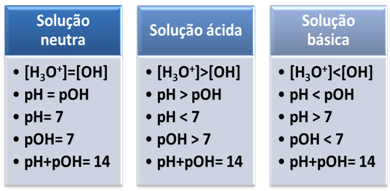
Medij se šteje za nevtralnega, če ima enako koncentracijo hidronijevih ionov (H3O+) in hidroksid (OH-).
Primer nevtralnega medija, ki celo služi kot standard za druge raztopine, je čista destilirana voda pri temperaturi 25 °C. Pri tej temperaturi ima točno 1. 10-7 mol/L obeh ionov. Torej vaš ionski produkt (Kw) je enako 10-14 (mol/L)2:
Kw = [H3O+]. [oh-]
Kw = (1. 10-7 mol/L). (1. 10-7 mol/L) = 10-14 (mol/L)2
pH in pOH sta podana spodaj:
pH= - log [H3O+] pOH= -log[OH-]
pH= - log 1. 10-7 pOH= - log 1. 10-7
pH = 7pOH = 7
To nam kaže, da je v nevtralni raztopini pH je enak pOH.
- Kisli medij:
V kislem mediju je koncentracija ionov H3O+ je večji od ionov OH-.
Takšno raztopino lahko dosežemo z dodajanjem majhnega dela ionov H3O+na primer s pomočjo kisline.
Po Le Chatelierjevem principu, ko je motnja povzročena v sistemu v ravnotežju, se ta nagiba k ponovni prilagoditvi, da bi zmanjšal učinke te sile. To pomeni, da če vodi dodamo kislino, ioni H3O+ bodo presežni in ravnovesje se bo premaknilo v obratno reakcijsko smer, v levo. Tako bodo ti presežni ioni reagirali z ioni OH
-. Tako je koncentracija OH ionov- se bo zmanjšala in raztopina bo postala kisla.
Ionski produkt (Kw) je vedno enak 10-14, ampak koncentracija ionov H3O+ je večja od koncentracije OH ionov-1. Zato je pH večji od pOH v kislem mediju, vendar je njegova vsota vedno enaka 14.
Prav tako je večja koncentracija ionov H3O+, večja je pH vrednost. Pri sobni temperaturi (25°C), pH < 7 in pOH > 7.

- Osnovna sredstva:
V osnovnem mediju je koncentracija ionov OH- je večji od ionov H3O+.
Če vodi dodamo bazo, to pomeni, da dodajamo ione OH.- in, kot je pojasnjeno v prejšnji točki, po Le Chatelierjevem principu, ravnotežje reakcije samoionizacija vode se bo premikala v nasprotni smeri, pri čemer bodo odvečni ioni reagirali z H ioni3O+, zmanjša vašo koncentracijo in naredi raztopino bazično.
V tem primeru bo pOH večji od pH. Pri sobni temperaturi (25°C), pH > 7 in pOH < 7.

na kratko:
Avtor: Jennifer Fogaça
Diplomirala iz kemije

