Molekule snovi niso vse ravne, kot da bi bile v eni ravnini. Navsezadnje so razpršeni v vesolju in njihovi atomi prevzamejo drugačno razporeditev ali razporeditev. Tako obstajajo različne geometrijske oblike za molekule vsake vrste snovi.
Eden najpreprostejših načinov za določanje geometrije molekule temelji na teoriji odboj elektronskih parov valenčne lupine (RPECV). Po tej teoriji elektronski pari osrednjega atoma delujejo kot elektronski oblaki ki se odbijajo. Na ta način so usmerjeni čim dlje drug od drugega. Molekularna geometrija bo odvisna od števila elektronskih parov okoli osrednjega atoma.
Ta elektronski oblak je lahko sestavljen iz elektronov, ki sodelujejo v vezi (enojnih, dvojnih ali trojnih) in tudi ne sodelujejo. Torej imamo:
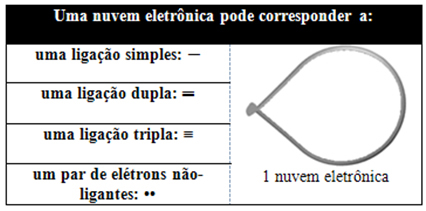
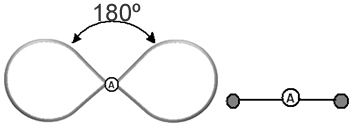
Pomaga si o tem oblaku razmišljati kot o privezanem balonu ali balonih, pri čemer je osrednji atom v središču njih. Na primer, v molekuli, ki ima okoli osrednjega atoma samo dva elektronska oblaka, večja možna razdalja med njima je kot 180° in posledično bo geometrija molekule linearno.
Zato lahko sklepamo o tem, kakšna bo molekularna geometrija večine molekul, če upoštevamo število atomov v molekulah in vezi, ki jih ustvari osrednji atom, preverjanje, ali ima pare elektronov.
Oglejte si spodnje primere:
- Molekule z 2 atomoma: vedno bodo linearno
Na primer:
H ─ H, H ─ Cl, F ─ F, O ═ O, C ≡ O.
- 3-atomna molekula: kotne ali trikotne
če je osrednji atom imajo par nevezujočih elektronov geometrija bo kotna, kot v primeru molekule SO2:
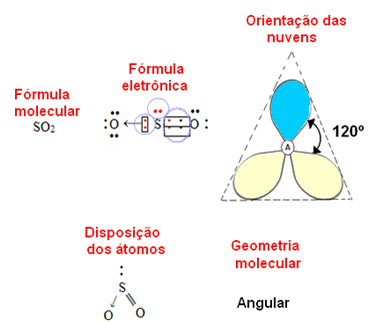
Upoštevajte, da modri elektronski oblak predstavlja pare elektronov, ki ne sodelujejo v vezi, rumenega pa kot pare elektronov, ki sodelujejo v vezi.
- 4-atomna molekula: ravna trigonalna (ali trikotna) ali piramidalna (ali trikotna piramida)
Če osrednji atom nima neparnega (nevezujočega) elektronskega para, je molekularna geometrija ravna trigonalna (ali trikotna). Poglejte primer BF3:

Če ima atom nevezujoče elektronske pare, bo geometrija molekule piramidalna (ali trigonalna piramida), kot v primeru amoniaka:

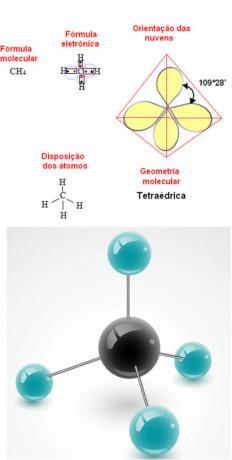
- 5-atomna molekula: tetraedrski
Primer metanske geometrije:
- Molekula s 6 atomi: trigonalna bipiramida ali trikotna piramida.
Primer je fosforjev pentaklorid (PCl5), ki ima nekaj povezav med fosforjem in klorom pod kotom 90°, druge pa 120°, ki tvorijo bipiramido s trikotno osnovo:
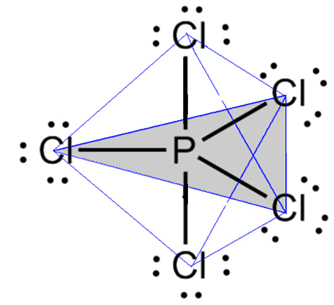
- 7-atomna molekula: oktaedra
Primer: žveplov heksafluorid (SF6), katerega koti so 90°.

Avtor: Jennifer Fogaça
Diplomirala iz kemije
vir: brazilska šola - https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm

