Francoski kemik Henri Louis Le Chatelier je ustvaril enega najbolj znanih zakonov kemije, ki napove odziv kemičnega sistema v ravnovesju, ko je izpostavljen spremembi.
Z rezultati svojih študij je oblikoval posploševanje kemijskega ravnovesja, ki navaja naslednje:
"Ko zunanji dejavnik deluje na sistem v ravnovesju, se premakne, vedno v smislu, da minimizira delovanje uporabljenega faktorja."
Ko je ravnovesje kemičnega sistema moteno, sistem deluje tako, da to motnjo zmanjša in povrne stabilnost.
Zato sistem predstavlja:
- začetno stanje ravnovesja.
- "neuravnoteženo" stanje s spremembo faktorja.
- novo stanje ravnovesja, ki nasprotuje spremembam.
Primeri zunanjih motenj, ki lahko vplivajo na kemijsko ravnovesje, so:
| Faktor | Motnje | Izdelano je |
|---|---|---|
| Koncentracija | Porast | Uživajte snov |
| Zmanjšajte | snov je proizvedena | |
| Pritisk | Porast | Premakne se na najmanjšo glasnost |
| Zmanjšajte | Premakne se na največjo glasnost | |
| Temperatura | Porast | Absorbira toploto in spremeni ravnotežno konstanto |
| Zmanjšajte | Sprošča toploto in spreminja ravnotežno konstanto | |
| Katalizator | Prisotnost | Reakcija se pospeši |
To načelo je zelo pomembno za kemično industrijo, saj je z reakcijami mogoče manipulirati in postopke narediti učinkovitejše in varčnejše.
Primer tega je postopek, ki ga je razvil Fritz Haber, ki je z Le Chatelierjevim načelom ekonomično ustvaril pot za proizvodnjo amoniaka iz atmosferskega dušika.
Nato bomo preučili kemijsko ravnovesje po Chatelierjevem zakonu in kako ga lahko motijo motenja.
vedeti več o:
- Kemijsko ravnotežje
- Ionsko ravnovesje
- Kislinsko-bazični kazalniki
Učinek koncentracije
Ko obstaja kemično ravnovesje, je sistem uravnotežen.
Sistem v ravnovesju lahko trpi zaradi motenj, kadar:
- Povečujemo koncentracijo sestavine reakcije.
- Znižamo koncentracijo sestavine reakcije.
Ko snov dodamo ali odstranimo iz kemijske reakcije, sistem nasprotuje spremembi, tako da porabi ali proizvede več te spojine, da se ponovno vzpostavi ravnovesje.
Koncentracije reaktantov in produktov se spremenijo, da se prilagodijo novemu ravnotežju, vendar ravnotežna konstanta ostaja enaka.
Primer:
Stanje:
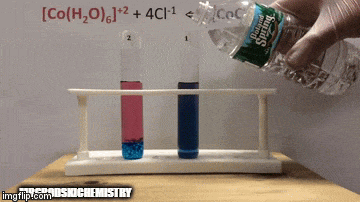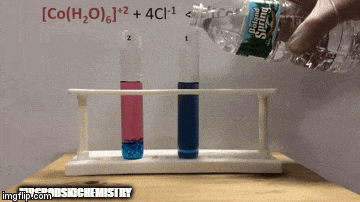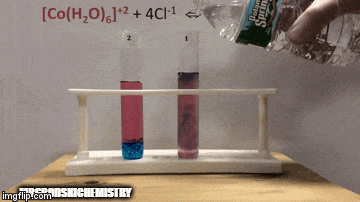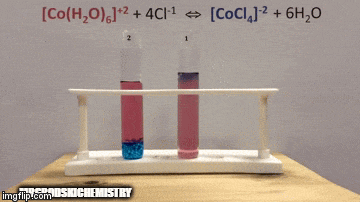
Reakcija ima večjo koncentracijo produktov, ker po modri barvi raztopine vidimo, da je [CoCl kompleks4]-2 prevladuje.
Voda je tudi produkt neposredne reakcije in ko povečamo njeno koncentracijo v raztopini, sistem nasprotuje spremembi, zaradi česar voda in kompleks reagirata.
Ravnotežje se premakne v levo, reverzno smer reakcije in povzroči povečanje koncentracije reaktantov, kar spremeni barvo raztopine.
Vpliv temperature
Sistem v ravnovesju lahko trpi zaradi motenj, kadar:
- Sistemska temperatura se poveča.
- Temperatura sistema se zmanjša.
Pri dodajanju ali odstranjevanju energije iz kemičnega sistema sistem nasprotuje spremembi, absorbira ali sprošča energijo, da se ponovno vzpostavi ravnovesje.
Ko sistem spreminja temperaturo, se kemijsko ravnovesje spremeni, kot sledi:
S povečanjem temperature je naklonjena endotermni reakciji in sistem absorbira toploto.
Po drugi strani pa je pri znižanju temperature naklonjena eksotermna reakcija in sistem sprošča toploto.
Primer:
V kemičnem ravnotežju:
Ko epruveto, ki vsebuje ta sistem, postavimo v čašo z vročo vodo, se temperatura sistema poveča in ravnotežje se premakne, tako da nastane več izdelkov.

To je zato, ker je neposredna reakcija endotermna in bo sistem ponovno vzpostavljen z absorpcijo toplote.
Poleg tega temperaturne razlike spreminjajo ravnotežne konstante.
učinek tlaka
Sistem v ravnovesju lahko trpi zaradi motenj, kadar:
- Skupni tlak v sistemu se poveča.
- Skupni sistemski tlak se zmanjša.
Ko povečujemo ali zmanjšujemo tlak kemičnega sistema, sistem nasprotuje spremembi in izpodriva ravnotežje v smislu manjše oziroma večje prostornine, vendar ne spremeni ravnotežne konstante.
Ko sistem spreminja prostornino, zmanjša delovanje pritiska na naslednji način:
Večji kot je pritisk na sistem, bo prišlo do krčenja prostornine in ravnotežje se bo premaknilo proti manjšemu številu molov.
Če se tlak zmanjša, se sistem širi, povečuje prostornino in smer reakcije se premakne v tisto z največjim številom molov.
Primer:
Celice našega telesa prejemajo kisik s kemičnim ravnovesjem:
Ta sistem se vzpostavi, ko kisik v zraku, ki ga vdihavamo, pride v stik s hemoglobinom v krvi, kar povzroči nastanek oksi-hemoglobina, ki prenaša kisik.
Ko se človek povzpne na goro, višja je dosežena nadmorska višina, nižja je količina in delni tlak O2 gor v zrak.
Ravnotežje, ki prenaša kisik v telesu, se premakne v levo in zmanjša količino oksi-hemoglobina, kar ogroža količino kisika, ki ga prejmejo celice.
Posledica tega je pojav vrtoglavice in utrujenosti, ki lahko vodi celo do smrti.
Telo poskuša reagirati tako, da proizvaja več hemoglobina. Vendar je to počasen postopek, ki zahteva nastavitev na nadmorski višini.

Ljudje, ki se lahko povzpnejo na Mount Everest, so tisti, ki so najbolj primerni za skrajno nadmorsko višino.
Katalizatorji
Uporaba katalizatorja vpliva na hitrost reakcije tako v neposredni kot v obratni reakciji.
Da pride do reakcije, je treba doseči minimalno energijo, da molekule trčijo in učinkovito reagirajo.
Katalizator, ko je vstavljen v kemični sistem, deluje tako, da zmanjša to aktivacijsko energijo tako, da tvori aktiviran kompleks in ustvari krajšo pot do kemičnega ravnovesja.
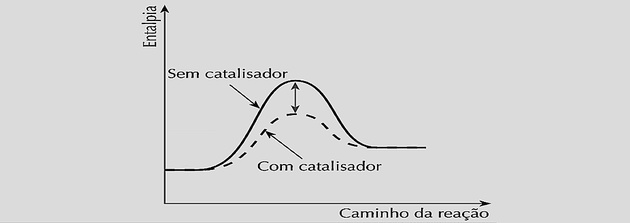
Z enakim povečanjem hitrosti reakcije zmanjšuje čas, potreben za dosego ravnovesja, kot je razvidno iz naslednjih grafov:
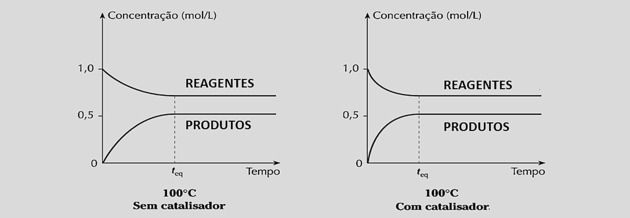
Vendar uporaba katalizatorjev ne spremeni donosa reakcije ali ravnotežne konstante, ker ne moti sestave zmesi.
sinteza amoniaka
Spojine na osnovi dušika se med drugim pogosto uporabljajo v kmetijskih gnojilih, eksplozivih, zdravilih. Zaradi tega nastanejo milijoni ton dušikovih spojin, kot je NH amoniak3, NH amonijev nitrat4PRI3 in sečnina H2NCONH2.
Zaradi svetovnega povpraševanja po dušikovih spojinah, predvsem za kmetijske dejavnosti, čilska NaNO salitra3, glavni vir dušikovih spojin, je bil najpogosteje uporabljen do začetka 20. stoletja, vendar naravna solanka ne bo mogla zagotoviti trenutnega povpraševanja.
Zanimivo je, da je atmosferski zrak mešanica plinov, sestavljena iz več kot 70% dušika2. Vendar zaradi stabilnosti trojne vezi postane zelo težko prekiniti to vez in tvoriti nove spojine.
Rešitev tega problema je predlagal nemški kemik Fritz Haber. Sinteza amoniaka, ki jo je predlagal Haber, prinaša naslednje kemično ravnovesje:
Za industrijsko izvedbo ga je Carl Bosch izpopolnil in je doslej najbolj uporabljen za zajemanje dušika iz zraka s poudarkom na pridobivanju dušikovih spojin.
Z uporabo načela Le Chatelier lahko kemično ravnovesje povečamo, če:
Dodaj H2 in povzroči, da sistem nasprotuje spremembi in reagira na nižjo koncentracijo tega reaktanta.
Tako je H2 in ne2 porabijo se hkrati, da proizvedejo več izdelkov in ustvarijo novo ravnotežno stanje.
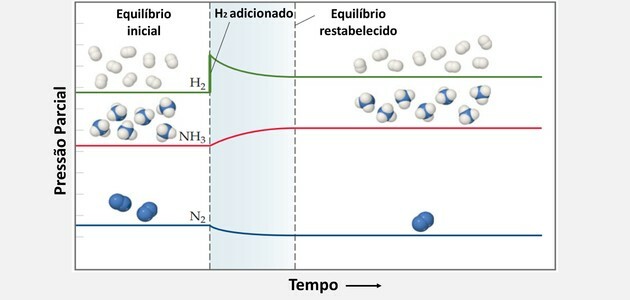
Prav tako se pri dodajanju več dušika ravnotežje premakne v desno.
Industrijsko se ravnovesje premakne z nenehnim odstranjevanjem NH3 sistema s selektivnim utekočinjanjem, s čimer se poveča reakcijski izkoristek, saj ravnovesje, ki se ponovno vzpostavi, ponavadi tvori več produkta.
Sinteza Haber-Bosch je ena najpomembnejših aplikacij študij kemijskega ravnovesja.
Zaradi pomembnosti te sinteze je Haber leta 1918 prejel Nobelovo nagrado za kemijo, Bosch pa je leta 1931 prejel nagrado.
Vaje za premik ravnotežja
Zdaj, ko veste, kako razlagati spremembe, ki se lahko pojavijo v kemičnem ravnovesju, s temi vestibularnimi vprašanji preizkusite svoje znanje.
1. (UFPE) Najprimernejši antacidi bi morali biti tisti, ki kislosti v želodcu ne zmanjšajo preveč. Kadar je zmanjšanje kislosti preveliko, želodec izloča odvečno kislino. Ta učinek je znan kot "ponovitev kisline". Kateri od spodnjih elementov bi lahko bil povezan s tem učinkom?
a) Zakon o ohranjanju energije.
b) Paulijevo načelo izključitve.
c) Načelo Le Chatelierja.
d) Prvo načelo termodinamike.
e) Heisenbergovo načelo negotovosti.
Pravilna alternativa: c) Le Chatelierjevo načelo.
Antacidi so šibke baze, ki delujejo tako, da povečajo pH želodca in posledično zmanjšajo kislost.
Zmanjšanje kislosti nastane z nevtralizacijo klorovodikove kisline v želodcu. Če pa preveč zmanjša kislost, lahko ustvari neravnovesje v telesu, saj želodec deluje v kislem okolju.
Kot navaja Le Chatelierjevo načelo, ko bo sistem v ravnovesju izpostavljen motnjam, bo tej spremembi nasprotovanje, tako da bo ravnovesje ponovno vzpostavljeno.
Na ta način bo telo proizvedlo več klorovodikove kisline, ki bo povzročila učinek "kislega ponovnega ujemanja".
Druga načela, predstavljena v alternativah, obravnavajo:
a) Zakon o ohranjanju energije: v nizu preobrazb se ohrani celotna energija sistema.
b) Paulijevo načelo izključitve: v atomu dva elektrona ne moreta imeti enakega nabora kvantnih števil.
d) Prvo načelo termodinamike: sprememba notranje energije sistema je razlika med izmenjano toploto in opravljenim delom.
e) Heisenbergovo načelo negotovosti: hitrosti in položaja elektrona ni mogoče določiti v danem trenutku.
Glede ravnotežnega sistema lahko pravilno trdimo, da:
a) prisotnost katalizatorja vpliva na sestavo zmesi.
b) prisotnost katalizatorja vpliva na ravnotežno konstanto.
c) zvišanje tlaka zmanjša količino CH4(g).
d) povišanje temperature vpliva na ravnotežno konstanto.
e) povišanje temperature zmanjša količino CO(g) .
Pravilna alternativa: d) zvišanje temperature vpliva na ravnotežno konstanto.
Pri dvigovanju temperature bo prizadeta neposredna reakcija, ki je endotermna, saj bo sistem za ponovno vzpostavitev ravnotežja absorbiral energijo in jo premaknil v desno.
S premikanjem ravnotežja v neposredno smer se poveča količina oblikovanih izdelkov.
Konstanta ravnotežja je neposredno sorazmerna s koncentracijo izdelkov: večja je količina izdelkov, večja je vrednost konstante.
Takrat lahko opazimo, da zvišanje temperature poveča količino CO in H2.
Povečanje tlaka premakne ravnotežje v obratno reakcijo, saj se ravnotežje premakne proti najmanjšemu številu molov. S tem je količina CH4 in H2The je povečan.
Uporaba katalizatorja ne vpliva na ravnovesno konstanto in sestavo zmesi. Deloval bo le tako, da bo ravnovesje hitreje doseženo.
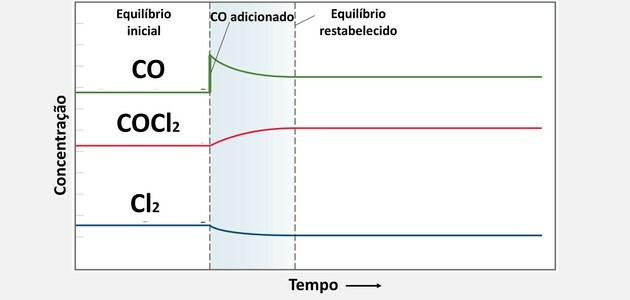
3. (UFC) V študiji delovanja strupenega plina COCl2, ki se uporablja kot kemično orožje, opazimo postopek razgradnje glede na reakcijo:
Iz ravnotežnega stanja smo dodali 0,10 mol CO in sistem je čez nekaj časa dosegel novo ravnotežno stanje. Izberite možnost, ki kaže, kako so nove ravnotežne koncentracije povezane s starimi.
| [COCl2] | [CO] | [Kl2] | |
| The) | novo> staro | novo> staro | novo |
| B) | novo> staro | novo> staro | novo> staro |
| ç) | novo | novo> staro | novo |
| d) | novo> staro | novo | novo |
| in) | enako | enako | enako |
Pravilna alternativa:
| [COCl2] | [CO] | [Kl2] | |
| The) |
Ko dodamo novo snov, sistem to snov porabi za vzpostavitev ravnovesja, saj se je koncentracija povečala.
Ta poraba nastane tako, da snov reagira z drugo spojino in tako ustvari več izdelka.
Ko bomo torej povečali koncentracijo CO, bo prišlo do porabe, vendar ne do te mere, da bi postala nižja od koncentracije v začetnem stanju, saj se bo njena poraba pojavila skupaj z drugo komponenta.
Že koncentracija Cl2 postane manjši od začetnega, saj je moral reagirati s količino dodanega CO
Od stika obeh snovi se je koncentracija COCl povečala2, saj gre za oblikovan izdelek.
Te spremembe v kemičnem ravnovesju so razvidne iz naslednjega grafa:
4. (UFV) Eksperimentalna študija kemijske reakcije v ravnotežju je pokazala, da se je povečanje temperatura je spodbujala nastajanje proizvodov, medtem ko je povišanje tlaka spodbujalo nastajanje produktov reagenti. Na podlagi teh informacij in ob zavedanju, da so A, B, C in D plini, označite alternativo, ki predstavlja preučevano enačbo:
| The) | ||
| B) | ||
| ç) | ||
| d) | ||
| in) |
Pravilna alternativa:
| The) |
Ko temperatura narašča, sistem absorbira toploto, da vzpostavi ravnovesje in s tem daje prednost endotermni reakciji, katere ∆H je pozitivna.
Alternative, ki ustrezajo tvorjenju izdelkov s povečanjem temperature, so: a, b in d.
Ko pa se tlak poveča, se ravnotežje premakne proti najmanjši prostornini, torej tisti z najmanjšim številom molov.
Da se reakcija premakne proti reaktantom, mora biti v tej smeri reakcije manjše število molov glede na produkte.
To opazimo le pri prvi alternativi.
5. (UEMG) Naslednje enačbe predstavljajo sisteme v ravnovesju. Kateri je edini sistem, ki se ne spreminja s spremembo tlaka?
a) OS2 (g) + 1/2 O2 (g) ⇔ TAKO3(g)
b) CO2 (g) + H2 (g) ⇔ CO(g) + H2O(g)
c) Ne2 (g) + 3 H2 (g) NH 2 NH3(g)
d) 2 CO2 (g) CO 2 CO(g) + O2 (g)
Pravilna alternativa: b) CO2 (g) + H2 (g) ⇔ CO(g) + H2O(g)
Ko sistem spremeni skupni tlak, se ravnovesje ponovno vzpostavi s spremembo prostornine.
Če se tlak poveča, se prostornina zmanjša in ravnotežje premakne na najmanjše število molov.
Ko se tlak zmanjša, se glasnost poveča in premika tehtnico v smislu večjega števila molov.
Ko pa nastane enako število molov reagirajočih snovi in produktov, ravnovesja ni mogoče spremeniti, saj se prostornina ne spremeni.
Število molov poznamo po stehiometričnih koeficientih ob vsaki snovi.
To lahko vidimo v alternativni enačbi
b) CO2 (g) + H2 (g) ⇔ CO(g) + H2O(g)
kjer je 1 mol CO2 reagira z 1 molom H2 da nastane 1 mol CO in 1 mol H2O.
V obe smeri reakcije sta 2 mola, zato spremembe tlaka ne bi spremenile prostornine.
Na tem seznamu, ki smo ga pripravili, si oglejte več vprašanj o premiku kemijskega ravnotežja s komentirano ločljivostjo: vaje za kemično ravnotežje.
Kdo je bil Le Chatelier?