THE ionizacijska konstanta daje Voda(Kw), O vodikov potencial(pH) to je hidroksilni potencial (pOH) so ukrepov pomembno za izračune, ki vključujejo kemično ravnotežje v kislih in bazičnih raztopinah, pa tudi pri določanju koncentracije ionov H+ in oh- zadevnih rešitev.
Kaj je Kw?
Jonski produkt vode ali Kw (to wpomeni vode - voda, v angleščini), je konstanta, ki se uporablja za predstavitev ravnotežje, ustvarjeno s samoionizacijo vode. Tudi pri zelo majhni hitrosti voda ionizira, pri čemer nastajajo ioni H+ in oh-, v skladu z naslednjo kemijsko enačbo:
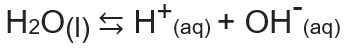
Analiziramo enačbo in ugotovimo, da ko ionizacija iz molekule čiste vode nastane H-ion.+ in OH ion-, to je koncentracija teh ionov bo vedno enaka. Tudi kadar pride do povišanja temperature, ki povzroči povečanje stopnje ionizacije, ostanejo koncentracije enake.
Preberite tudi:Ionizacijska energija
Ne ustavi se zdaj... Po oglaševanju je še več;)
Na podlagi eksperimentalnih meritev je bila izračunana koncentracija ionov H+ in oh
- (ki izhaja iz samoionizacije vode) pri 25 ° C in vrednosti 1. 10-7 mol / L. To je, 1 milijarde molekul vode, samo dva sta ionizirana. To kaže, da ima čista voda nizko stopnjo ionizacije, in pojasnjuje zelo nizko Električna prevodnost čiste vode.Glede na zgoraj prikazano lahko napišemo izraz konstante vodne bilance:

Uporaba vrednosti koncentracije ionov H+ in oh- pri 25 ° C lahko izračunamo vrednost Kw:
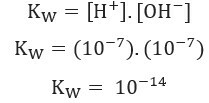
Kot smo že omenili, je ta vrednost Kw spreminja z naraščajočo temperaturo, kot je prikazano v spodnji tabeli:
T (° C) |
Kw |
10 |
0,29. 10-14 |
20 |
0,68. 10-14 |
25 |
1,00. 10-14 |
30 |
1,47. 10-14 |
40 |
2,92. 10-14 |
60 |
9,40. 10-14 |
Če želite izvedeti več o tej temi, preberite naše besedilo: Ionski vodni izdelek.
Kaj sta pH in pOH?

kratica pH pomeni vodikov potencial in ga je ustvaril danski biokemik Soren Sorensen, leta 1909, da bi olajšali delo z koncentracije vodikovih ionov [H+], ki so običajno izražene v decimalnih številih. Če želite izvedeti več o tej temi, preberite naše besedilo: Kaj je pH?
Tovrsten zapis označuje vsebnost H ionov+ prisoten v raztopini in je opredeljen z matematičnim izrazom:
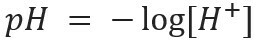
Podobno lahko določimo pOH ali hidroksilnega potenciala, kar nam pove Vsebnost OH ionov- prisoten v raztopini. Njegov matematični izraz je:
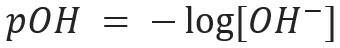
V vodni raztopini bodo vedno ioni H+ in oh- (zaradi ionizacije vode), ki bo uporabljena za opredelitev raztopine v kislo ali osnovno. Več H ionov+ v raztopini je, bolj kisla bo. Posledično prisotnost ionov OH- v rešitvi bo bolj osnovna. Če je količina teh ionov v ravnovesju, bo raztopina razvrščena kot nevtralno.
Lestvica pH
Lestvica pH je prikazana z vrednostmi od 0 do 14 (vrednosti, izmerjene pri 25 ° C). Oglejte si lestvico pH na spodnji sliki:

Nižji je pHrešitve,večja je njegova kislost, in bližje koncu lestvice, to je bližje 14, večji bo njen osnovni značaj. Na primer, limonin sok ima pH 2, belila pa 12.
Kako izračunati pH in pOH
poznavanje koncentracija ionov, mi lahko izračunajte vrednosti pH in pOH raztopin, in ob poznavanju potencialnih vrednosti izračunamo koncentracija ionov v raztopinah. V ta namen se uporabljajo naslednji izrazi:
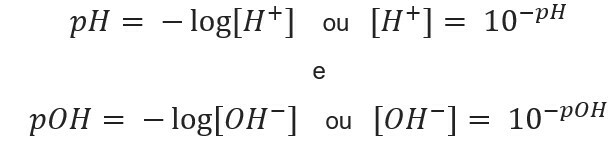
Pojdimo na primere:
Primer 1
Če želimo vedeti pH raztopine z [H+] = 0,001 mol / l, samo uporabite prej predstavljeno formulo:
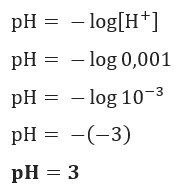
2. primer
Zdaj, da ugotovimo, kakšna je koncentracija OH- raztopine s pOH = 5, samo nadomestite vrednost v naslednji formuli:

Če uporabimo enako lestvico potencialov za ionsko ravnovesje vode, bomo imeli:
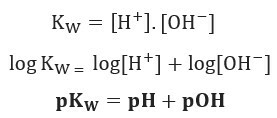
Kot rečeno, je pri 25 ° C Kw = 10-14. Zato:

S tem lahko izračunamo pOH raztopine glede na njen pH. Če imamo raztopino s pH 3, bo njen pOH 11.
Izvedite več: Nevtralni, kisli in bazični mediji
rešene vaje
Vprašanje 1 (UEFS-BA) Koncentracija ionov OH–(tukaj) v dani raztopini amonijevega hidroksida pri 25 ° C je enako 1,10–3 mol / L. POH te rešitve je:
a) 0
b) 1
c) 3
d) 11.
e) 13
Resolucija: Črka C. Če imamo [OH–] = 10–3 mol / L, tako da bo vaš pOH enak 3.
Poglej:
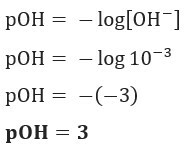
Vprašanje 2 (UEA-AM) Upoštevajte naslednje informacije, pridobljene z nalepko za mineralno vodo v mestu Porto Seguro (BA):
nitrata 1,45 mg / l
pH pri 25 ° C 4,51
Ta mineralna voda je
a) kislo in ima [H+] –].
b) kislo in ima [H+]> [OH–].
c) nevtralen in ima [H+] = [OH–].
d) osnovno in ima [H+]> [OH–].
e) osnovno in ima [H+] –].
Resolucija: Črka B. Ker je pH mineralne vode, naveden na nalepki, manjši od 7, lahko rečemo, da je kisla raztopina in zato koncentracija ionov H+ je večja od OH-.
Vprašanje 3 (UEA-AM) Eden od načinov hitrega pridobivanja plinastega vodika v laboratoriju je reakcija kovinskega cinka v prahu s klorovodikovo kislino (HCl) pri koncentraciji 1,0 mol / l:
Zn (s) + 2 HCl (vod.) → ZnCl2 (vodno) + H2 (g)
Glede na to, da je klorovodikova kislina 100% ionizirana in da je raztopina pri 25 ° C, je pravilno trditi, da je pH raztopine klorovodikove kisline, omenjene v besedilu,
- 0
- 1
- 3
- 13
- 14
Resolucija:Črka a. PH raztopine lahko izračunamo s koncentracijo HCl, navedeno v besedilu, saj je koncentracija [H, ker je 100% ionizirana+] bo enako, ker za vsako ionizirano molekulo HCl en ion H+ bo ustvarjena. Zato:
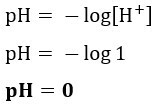
Avtor Victor Ferreira
Učitelj kemije