Termokemija je del kemije, ki preučuje količino toplote (energije), vključene v kemične reakcije.
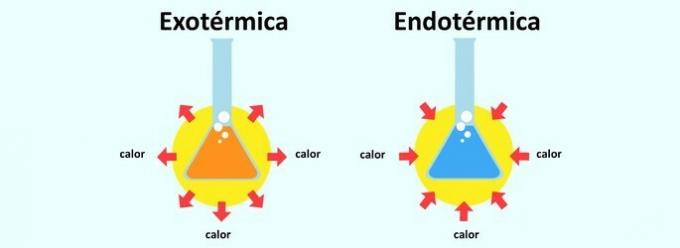
Ko reakcija sprošča toploto, je razvrščena kot eksotermna. Absorpcija toplote v reakciji povzroči, da je endotermna.
Termokemija preučuje tudi prenos energije pri nekaterih fizikalnih pojavih, na primer pri spremembah stanja snovi.
Termokemija in toplota
V kemijskih reakcijah se energija lahko absorbira ali sprosti. Ta prenos toplote poteka od telesa z najvišjo temperaturo do tistega z najnižjo temperaturo.
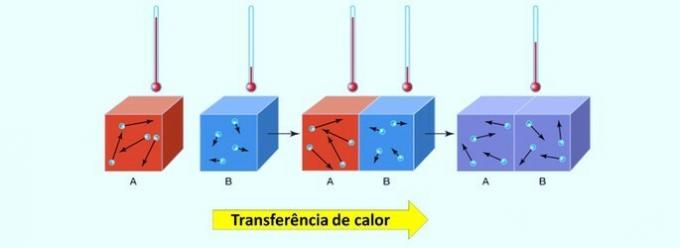
Omeniti velja, da je toplota, imenovana tudi toplotna energija, koncept, ki določa izmenjavo toplotne energije med dvema telesoma. O toplotna bilanca je določena, ko oba materiala dosežeta enako temperaturo.
Endotermne in eksotermne reakcije
to se imenuje endotermna reakcija reakcija, v kateri se absorbira toplota. Na ta način telo absorbira toploto iz okolja, v katerem je vstavljeno. Zato endotermna reakcija povzroči občutek hlajenja.
Primer: Ko drgne alkohol po roki, roka absorbira toploto te snovi. Ko pa pihamo po roki po prehodu alkohola, občutimo rahlo mrzlico, občutek, ki je posledica endotermne reakcije.
že eksotermna reakcija je obratno. To je sproščanje toplote in s tem občutek segreva.
Primer: V taborišču ljudje stojijo ob ognju, tako da toplota, ki jo oddaja plamen, ogreje okolico.
Toplotne izmenjave se dogajajo tudi pri spremembah leta 2007 fizično stanje. Izkazalo se je, da je pri prehodu s trdnega na tekočega in s tekočega na plin postopek endotermičen. Nasprotno pa je sprememba s plina na tekočino in s tekočine na trdo eksotermna.
entalpija
Entalpija (H) je energija izmenjava v reakcijah absorpcije in sproščanja energije, endotermni in eksotermni.
Naprave, ki bi lahko merila entalpijo, ni. Iz tega razloga se izmeri njegova variacija (ΔH), ki se izvede ob upoštevanju entalpije reaktanta (začetna energija) in entalpije proizvoda (končna energija).
Najpogostejše vrste entalpije so:
| Entalpija tvorbe | Absorbirana ali sproščena energija, potrebna za tvorbo 1 mola snovi. |
|---|---|
| Entalpija izgorevanja | Sproščena energija, ki povzroči zgorevanje 1 mola snovi. |
| Entalpija povezave | Energija, absorbirana pri pretrganju 1 mola kemične vezi v plinastem stanju. |
Medtem ko entalpija meri energijo, entropija meri stopnjo motnje kemijskih reakcij.
Hessov zakon
Germain Henry Hess je ugotovil, da:
Sprememba entalpije (ΔH) v kemijski reakciji je odvisna samo od začetnega in končnega stanja reakcije, ne glede na število reakcij.
Spreminjanje energije v skladu s Hessovim zakonom se ugotavlja z naslednjo formulo:
ΔH = Hf - Hjaz
Kje,
- ΔH: sprememba entalpije
- Hf: končna entalpija ali entalpija izdelka
- Hjaz: začetna entalpija ali entalpija reagenta
Iz tega sklepamo, da je sprememba entalpije negativna, ko se soočamo z eksotermno reakcijo. V zameno je sprememba entalpije pozitivna, kadar se soočamo z endotermno reakcijo.
Preverite ta besedila, če želite izvedeti še več o temi.:
- Termodinamika
- Kalorimetrija
- občutna toplota
- latentna toplota
Vaje s komentiranimi povratnimi informacijami
1. (Udesc / 2011) Glede na naslednje enačbe:
| (THE) | 2CO(g) + O2 (g) → 2CO2(g) | ΔH = - 565,6 kj |
| (B) | 2CH4O(g) +302 (g) → 2CO2(g) + 4H2O(1) | ΔH = - 1462,6 kj |
| (Ç) | 3O2 (g) → 2O3 (g) | ΔH = + 426,9 kj |
| (D) | Vera2O3 (g) + 3C(s) → 2Fe(s) + 3CO(g) | ΔH = +490,8 kj |
Upoštevajte naslednje predloge glede enačb:
JAZ. Reakciji (A) in (B) sta endotermni.
II. Reakciji (A) in (B) sta eksotermni.
III. Reakciji (C) in (D) sta eksotermni.
IV. Reakciji (C) in (D) sta endotermni.
V. Reakcija z največjim sproščanjem energije je (B).
VIDEL. Reakcija z največjim sproščanjem energije je (D).
Preverite pravilno možnost.
a) Resnične so le trditve II, III in V.
b) Resnične so le trditve I, III in VI.
c) Resnične so le trditve I, IV in VI.
d) Resnične so samo trditve II, V in VI.
e) Resnične so samo trditve II, IV in V.
Pravilna alternativa: e) Resnične so samo trditve II, IV in V.
a) NAPAK. Izjava III ni resnična.
V nasprotju s trditvijo III sta reakciji (C) in (D) endotermni, saj pozitivni znak v spremembi entalpije kaže na absorpcijo toplote.
b) NAPAK. Nobena od navedb, navedenih v tej alternativi, ni pravilna. Motijo se, ker:
- Reakciji (A) in (B) sta eksotermni, saj negativni predznak pri spremembi entalpije kaže na sproščanje toplote.
- Reakciji (C) in (D) sta endotermni, saj pozitivni znak pri spremembi entalpije kaže na absorpcijo toplote.
- Reakcija (D) ne sprošča energije, saj je endotermna.
c) NAPAK. Od treh navedb, navedenih v tej alternativi, je pravilna le IV. Druga dva sta napačna, ker:
- Reakciji (A) in (B) sta eksotermni, saj negativni predznak pri spremembi entalpije kaže na sproščanje toplote.
- Reakcija (D) ne sprošča energije, pozitivni znak pri spremembi entalpije kaže, da je reakcija endotermna.
d) NAPAK. Izjava VI ni resnična.
V nasprotju s trditvijo VI reakcija (D) ne sprošča energije, saj je endotermna.
a) PRAVILNO. Izjave so pravilne, ker:
- Reakciji (A) in (B) sta eksotermni, saj je sprememba energije negativna.
- Reakciji (C) in (D) sta endotermni, saj je vrednost ΔH pozitivna.
- Reakcija z največjim sproščanjem energije je (B), saj je med eksotermnimi reakcijami izreka ta tista z najvišjo vrednostjo z negativnim predznakom.
Ta besedila vam bodo pomagala povečati svoje znanje:
- Vaje iz termokemije
- kemijske transformacije
- Kemijske reakcije
2. (Enem / 2011) Nenavadna možnost za kuhanje fižola je uporaba termosa. V ponev položite del fižola in tri dele vode in pustite, da komplet vre približno 5 minut, nato pa ves material prenesite v termo. Približno 8 ur kasneje bo fižol kuhan.
Kuhanje fižola poteka v termosu, ker
a) voda reagira s fižolom in ta reakcija je eksotermna.
b) fižol še naprej absorbira toploto iz okoliške vode, saj gre za endotermni proces.
c) obravnavani sistem je praktično izoliran in ne dopušča, da fižol pridobi ali izgubi energijo.
d) termos zagotavlja dovolj energije za kuhanje fižola, ko se reakcija začne.
e) energija, ki sodeluje v reakciji, segreje vodo, ki ohranja stalno temperaturo, saj gre za eksotermni proces.
Pravilna alternativa: b) fižol še naprej absorbira toploto iz okoliške vode, saj gre za endotermni proces.
a) NAPAK. Za kemično reakcijo je značilno, da nastanejo nove snovi, ki se pri kuhanju fižola ne pojavijo.
b) PRAVILNO. Ko se voda segreje, pridobi toploto in termos ne dopušča, da bi se ta energija izgubila v okolju. Tako fižol absorbira toploto iz vode in kuha, pri čemer gre za endotermni postopek.
c) NAPAK. Sistem je izoliran od zunanjega okolja. Znotraj steklenice imata fižol in voda neposreden stik in zato izvajata toplotno izmenjavo.
d) NAPAK. Termo bučka ima funkcijo izolacije sistema, pri čemer mešanica v njej ne omogoča izmenjave toplote z okoljem.
e) NAPAK. Temperatura ni konstantna, saj voda, ki prenaša toploto na fižol, izgublja energijo, dokler temperaturi nista enaki.
Oglejte si spodnja besedila in izveste več o temah, zajetih v tej številki:
- Fizikalne in kemijske transformacije
- toplota in temperatura
- Termalna energija