Kemijska kinetika preučuje hitrost kemijskih reakcij in dejavnike, ki vplivajo na hitrost teh reakcij.
Uporabite spodnja vprašanja, da preizkusite svoje znanje in preverite komentarje resolucij.
Vprašanje 1
Glede dejavnikov, ki vplivajo na hitrost kemijske reakcije, NEMOČNO trditi, da:
a) Višja kot je koncentracija reaktantov, hitrejša je reakcija.
b) Večja je kontaktna površina, večja je reakcijska hitrost.
c) Višji je tlak, hitrejša je reakcija.
d) Višja kot je temperatura, hitrejša je reakcija.
e) Prisotnost katalizatorja ohranja hitrost reakcije konstantno.
Nepravilna alternativa: e) Prisotnost katalizatorja ohranja hitrost reakcije konstantno.
Katalizatorji povečajo hitrost reakcije, saj olajšajo tvorbo aktiviranega kompleksa med reaktanti.
S tem katalizatorji ustvarijo krajši mehanizem za razvoj reakcije, zaradi česar se hitrost poveča.
2. vprašanje
V skladu z _____________ se morajo med reagenti zgoditi učinkoviti trki za tvorbo produktov. Poleg tega je dovolj ___________, da pretrga kemične vezi reaktantov in tvori ___________, ki je vmesno stanje pred tvorbo produktov.
Besede, ki pravilno izpolnjujejo prazna mesta, so:
a) entalpija, kinetična energija in spremembe katalizatorja.
b) teorija trkov, aktivacijska energija in aktivirani kompleks.
c) hitrost reakcije, entalpija in inhibitor.
d) delni tlak, entropija in podlaga.
Pravilna alternativa: b) teorija trkov, aktivacijska energija in aktivirani kompleks.
V skladu s teorijo trkov so trki med reaktanti nujni za kemično reakcijo. Zato morajo biti snovi v ugodnem položaju, da so šoki učinkoviti.
Aktivacijska energija deluje kot energetska ovira, ki jo je treba premagati, da se pretrgajo vezi reakcijskih spojin. Nižja kot je aktivacijska energija, hitrejša je reakcija.
Aktivirani kompleks je nestabilna vmesna vrsta, ki nastane pred proizvodi.
3. vprašanje
O katalizatorjih so podane naslednje štiri izjave:
JAZ. Katalizator deluje tako, da poveča hitrost reakcije, vendar ne spremeni njene učinkovitosti.
II. Pri kemijski reakciji se katalizator ne porabi na reakcijski poti.
III. Katalizatorji ustvarijo alternativno pot za pretvorbo reaktantov v izdelke. Za to je potrebna večja aktivacijska energija.
IV. Katalizator lahko reakcijo pospeši le v smeri naprej.
Možnosti, ki predstavljajo pravilne informacije o katalizatorjih, so:
a) I in II
b) II in III
c) I in IV
d) Vse
Pravilna alternativa: a) I in II.
Katalizatorji se uporabljajo za pospešitev kemijskih reakcij. Reakcija z uporabo katalizatorja ne spremeni njegovega izkoristka, torej pričakovane količine produkta, toda v krajšem času.
Med kemično reakcijo se katalizatorji ne porabijo, pomagajo pri tvorbi aktiviranega kompleksa. Zato je na koncu kemijske reakcije mogoče obnoviti katalizator.
Katalizatorji lahko zmanjšajo reakcijski čas z ustvarjanjem alternativnega mehanizma za tvorbo produktov z nižjo aktivacijsko energijo. Zato se reakcija pojavi hitreje.
Katalizatorji delujejo tako v smeri naprej kot v obratni smeri reakcije.
4. vprašanje
Kako hitro poteka kemična reakcija, je odvisno od:
JAZ. Število učinkovitih trkov med reagenti.
II. Dovolj energije za preureditev atomov.
III. Ugodna orientacija molekul.
IV. Nastanek aktiviranega kompleksa.
a) I in II
b) II in IV
c) I, II in III
d) I, II, III in IV
Pravilna alternativa: d) I, II, III in IV.
Do učinkovitih trkov pride, ko so reaktanti v položajih, ugodnih za udarce, kar bo spodbudilo prerazporeditev atomov.
Aktivacijska energija mora biti zadostna, da povzroči trk reaktantov prekinitev vezi in nastanek aktiviranega kompleksa.
Niso vsa trčenja med reakcijskimi delci povzročila reakcijo. Usmerjenost trčenja je pomembna za nastanek produktov.
Aktivirani kompleks je vmesno in nestabilno stanje pred tvorbo izdelkov. Nastane, ko je aktivacijska energija reakcije presežena.
5. vprašanje
Ogljikov dioksid je plin, ki nastane v reakciji med ogljikovim monoksidom in kisikovimi plini, v skladu s spodnjo kemijsko enačbo.
CO(g) + ½2 (g) → CO2 (g)
Ko vemo, da je bilo v 5 minutah reakcije porabljenih 2,5 mol CO, kolikšna je hitrost razvoja reakcije glede na porabo O2?
a) 0,2 mol. min-1
b) 1,5 mol. min-1
c) 2,0 mol. min-1
d) 0,25 mol. min-1
Pravilna alternativa: d) 0,25 mol. min-1
Za odgovor na to vprašanje moramo pogledati kemijsko enačbo.
CO(g) + ½2 (g) → CO2 (g)
Upoštevajte, da 1 mol ogljikovega monoksida reagira z ½ mola kisika in tvori 1 mol ogljikovega dioksida.
Količina, navedena v izjavi, se nanaša na ogljikov monoksid, odgovor pa mora biti v smislu kisika. Za to moramo izvesti pravilo treh in najti količino kisika.
1 mol CO - ½ mol O2
2,5 mol CO - x O2
x = 1,25 mol
Zdaj uporabimo vrednosti v formuli za hitrost razvoja reakcije.
Zato je hitrost razvoja reakcije glede na kisik 0,25 mol.min-1.
6. vprašanje
Upoštevajte grafični prikaz razvoja hipotetične kemijske reakcije, ki povezuje energijo in reakcijsko pot.
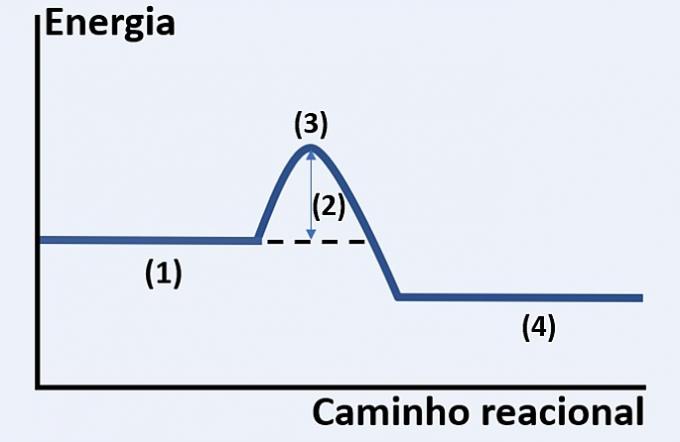
Preverite možnost, ki pravilno nadomešča (1), (2), (3) oziroma (4).
a) podlage, sproščena toplota, največje energijsko stanje in konec reakcije.
b) reagenti, aktivacijska energija, aktivirani kompleks in proizvodi.
c) reaktanti, kinetična energija, katalizator in substrati.
d) reaktanti, absorbirana toplota, toplotna energija in proizvodi.
Pravilna alternativa: b) reagenti, aktivacijska energija, aktivirani kompleks in proizvodi.
Prikazani graf prikazuje endotermno reakcijo, to pomeni, da pride do absorpcije energije.
Ti reagenti (1) so na začetku grafa in aktivacijska energija (2) ustreza razliki med energijo, shranjeno v reaktantih in v kompleks aktiviran (3). Nazadnje, po prehodu vmesnega stanja je nastala izdelkov (4).
Zato morajo reaktanti premagati aktivacijsko energijo, da svoje atome preuredijo v vmesno strukturo, imenovano aktivirani kompleks, da nastanejo produkti.
7. vprašanje
Snov A se lahko razgradi in postane snov B. Opazujte razvoj te reakcije na spodnji sliki.

Glede hitrosti reakcije lahko rečemo, da:
a) Snov A se razgradi med 0 in 15 s s hitrostjo 0,35 mol.s-1.
b) Snov A se razgradi med 15 in 30 s s hitrostjo 0,02 mol.s-1.
c) Snov A se razgradi med 0 in 15 s s hitrostjo 0,04 mol.s-1.
d) Snov A se razgradi med 15 in 30 s s hitrostjo 0,03 mol.s-1.
Pravilna alternativa: d) Snov A se razgradi med 15 in 30 s s hitrostjo 0,03 mol.s-1.
Hitrost razgradnje snovi A lahko izračunamo po formuli:
Izračunajmo hitrost reakcije glede na snov A med danimi intervali.
Razpon med 0 in 15:
Razpon med 15 in 30:
Zato je alternativa d pravilna, saj se snov A razgradi med 15 in 30 s s hitrostjo 0,03 mol.s.-1.
vprašanje 8
Razmislite o naslednji hipotetični reakciji.
aA + bB → cC + dD
Upoštevajte spremembe koncentracije A in C spodaj.
| Čas (i) | 0 | 5 | 10 | 15 | 20 | 25 |
|---|---|---|---|---|---|---|
| Poraba A (mol / L) | 7,5 | 6,0 | 4,5 | 3,0 | 2,5 | 1,0 |
| Tvorba C (mol / l) | 0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
Na podlagi informacij iz vprašanja, kakšna je stopnja porabe A in hitrost tvorbe C v intervalu med 5 in 25 min?
a) 0,3 mol. L-1.s-1 in 0,1 mol. L-1.s-1
b) - 0,1 mol. L-1.s-1 in 0,3 mol. L-1.s-1
c) - 0,25 mol. L-1.s-1 in 0,1 mol. L-1.s-1
d) 0,1 mol. L-1.s-1 in 0,3 mol. L-1.s-1
Pravilna alternativa: c) - 0,25 mol. L-1.s-1 in 0,1 mol. L-1.s-1.
Stopnja porabe:
Stopnja C treninga:
Zato se v reakciji A porabi s hitrostjo 0,25 mol.s-1, zato je njegova vrednost negativna, medtem ko B nastane s hitrostjo 0,1 mol. L-1.s-1.
Preberite tudi vi:
- Kemična kinetika
- termokemija
- Kemijsko ravnotežje
- Kemijske reakcije