Besedilo Titracija je pokazala, kako se izvaja ta tehnika volumetrične analize, katere glavni cilj je določite koncentracijo raztopine po njeni reakciji z drugo raztopino znane koncentracije.
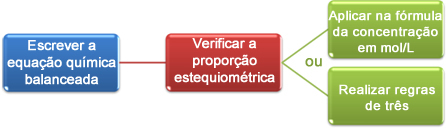
Zdaj bomo videli, kako uporabiti podatke, pridobljene s titracijo, da dosežemo želeno koncentracijo, ki je lahko kislina ali baza v raztopini. Za to so v bistvu trije koraki:
Oglejmo si primer:
Recimo, da je imel kemik raztopino ocetne kisline (kis (CH3COOH(tukaj))) in želel ugotoviti njegovo koncentracijo v mol / L. Nato je v Erlenmeyerjevo bučko dal 20,0 ml kisa (titriranega) in dodal indikator fenolftaleina. Nato je 100 ml birete napolnil z natrijevim hidroksidom (NaOH) z znano koncentracijo (titrant), ki je enaka 1,0 mol / L. Končno je kemik izvedel titracijo in opazil, da je pri porabi 24 ml NaOH prišlo do spremembe barve (prelomnica - ko je titracijo ustavil).

Na podlagi tega poskusa je pridobil naslednje podatke:
MCH3COOH= ?
VCH3COOH = 20 ml = 0,02 L
MNaOH = 24 ml = 0,024 L
VNaOH = 1,0 mol / l
Kjer je M = koncentracija v mol / L in V = prostornina v L.
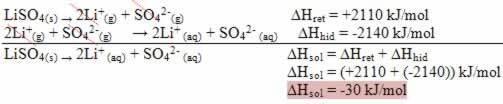
Da bi ugotovili koncentracijo ocetne kisline, moramo najprej vedeti, kako napisati kemijsko enačbo, ki predstavlja nevtralizirajočo reakcijo, ki se je zgodila pravilno uravnoteženo. V tem primeru je reakcija naslednja:
1 CH3COOH(tukaj) + 1 NaOH(tukaj) → 1 NaC2H3O2 (aq) + 1 ura2O(ℓ)
Ta del je pomemben za prikaz stehiometričnega razmerja, pri katerem reagenti reagirajo. Upoštevajte, da je razmerje 1: 1, to pomeni, da je za vsak mol ocetne kisline potreben 1 mol natrijevega hidroksida.
Zdaj lahko izračune nadaljujemo na dva načina:
(1.) Skozi formulo: M1. V1 = M2. V2
Ker je stehiometrično razmerje 1: 1, moramo: štCH3COOH = nNaOH .
Ne ustavi se zdaj... Po oglaševanju je še več;)
Biti M = n / V → n = M. V. Tako pridemo do zgornjega seznama, ki ga lahko v tem primeru zapišemo takole: MCH3COOH. CH3COOH = MNaOH. VNaOH
Torej, samo zamenjajte vrednosti te formule:
MCH3COOH. V CH3COOH = MNaOH. VNaOH
MCH3COOH. 0,02 L = 1,0 mol / l. 0,024 L
MCH3COOH = 0,024 mol
0,02 L
MCH3COOH = 1,2 mol / l
Zato je bila začetna koncentracija raztopine ocetne kisline, naš naslov, 1,2 mol / l.
Pomembno: Če stehiometrično razmerje ne bi bilo 1: 1, bi bilo dovolj, da koncentracijo snovi v mol / L (M) pomnožimo z njihovimi koeficienti. Če bi bilo na primer razmerje 1: 2, bi imeli naslednje:
M1. V1 = 2. M2. V2
Toda tu je še en način za izvedbo teh izračunov:
(2.) S pravili treh:
1 CH3COOH(tukaj) + 1 NaOH(tukaj) → 1 CH3COONa(tukaj) + 1 ura2O(ℓ)
1 mol 1 mol 1 mol 1 mol
1. 60g 1. 40 g 1. 82 g 1. 18 g
Te mase so izračunane molekulske mase za vsako snov.
* Vedeti, da je porabljena prostornina 1,0 mol / L raztopine NaOH(tukaj) je bilo 24 ml, lahko najprej ugotovimo količino snovi (mol) NaOH, ki je reagirala:
1 mol NaOH → 1,0 L
1 mol NaOH 1000 ml
x 24 ml
x = 0,024 mol NaOH
* Ker je razmerje 1: 1, mora biti količina snovi (mol) ocetne kisline enaka NaOH: 0,024 mol.
Opazovanje: Če bi bilo stehiometrično razmerje drugačno, bi to upoštevali v tem delu. Na primer, če bi bilo 1: 3 in bi bila količina snovi ene kemično reaktivne vrste enaka 0,024 mola, bi bila količina druge snovi trojna: 0,072.
* Zdaj izračunamo:
20 ml kisa 0,024 mol ocetne kisline
1000 ml kisa in
y = 1,2 mol
To pomeni, da je 1,2 mol / L, kar je enaka vrednost kot pri prejšnji metodi.
Avtorica Jennifer Fogaça
Diplomiral iz kemije