Topilo in topilo sta sestavni deli homogene zmesi, imenovane kemična raztopina.
- Topljeno: je snov, ki je razpršena v topilu. Ustreza snovi, ki se bo raztopila in se v raztopini na splošno predstavi v manjši količini.
- Topilo: je snov, v kateri se bo raztopljena raztopljena snov ustvarila nov proizvod. V raztopini se predstavlja v večji količini.
Raztapljanje med topljeno snovjo (dispergirano) in vehiklom (dispergatorjem) poteka z interakcijami med njihovimi molekulami.
Razlika med tema dvema komponentama raztopine je v tem, da je topljeno sredstvo snov, ki se bo raztopilo, topilo pa snov, ki bo vplivala na raztapljanje.
Najbolj znano topilo je voda, ki velja za univerzalno topilo. To je zato, ker ima sposobnost raztapljanja velike količine snovi.
Primeri topil in topil
Oglejte si nekaj primerov kemičnih raztopin in odkrijte topila in topila vsake od njih:
Voda in sol
- Topljena snov: kuhinjska sol - natrijev klorid (NaCl)
- Topilo: Voda
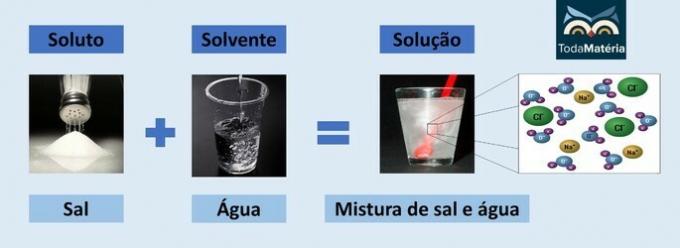
Ker je ionska spojina, natrijev klorid v raztopini disociira in tvori ione, ki jih nato solvatijo molekule Voda.
Pozitivni pol vode (H+) sodeluje z anionom soli (Cl-) in negativni pol vode (O2-) sodeluje s kationom (Na+).
To je vrsta elektrolitske raztopine, saj so ionske vrste v raztopini sposobne voditi električni tok.
voda in sladkor
- Topljena snov: sladkor - saharoza (C12H22O11)
- Topilo: Voda

Sladkor je kovalentna spojina in ko se raztopi v vodi molekul razpršijo se, vendar ne spremenijo identitete.
Ta vodna raztopina je razvrščena kot neelektrolitska, saj je raztopljena raztopina v raztopini nevtralna in zato ne reagira z vodo.
Kis
- Topljena snov: ocetna kislina (CH3COOH)
- Topilo: Voda

Kis je raztopina, ki vsebuje vsaj 4% ocetne kisline, a karboksilna kislina ki je polarna in preko vodikovih vezi sodeluje z vodo, tudi polarno.
Pomembno pravilo topnosti je, da se podobno raztopi podobno. Polarne spojine se raztopijo v polarnih topilih, nepolarne snovi pa v nepolarnih topilih.
Druge rešitve
Poleg tekočih raztopin obstajajo tudi plinaste in trdne raztopine.
Zrak, ki ga vdihavamo, je primer plinaste raztopine, katere plini v večji količini so dušik (78%) in kisik (21%).
Ob kovinske zlitine so trdne rešitve. Na primer, medenina (cink in baker) je mešanica, ki se uporablja za izdelavo glasbil.
Bi radi pridobili več znanja? Torej preberite ta druga besedila:
- Kemične rešitve
- medmolekularne sile
- Homogene in heterogene mešanice
Kaj je koeficient topnosti?
Koeficient topnosti je meja topljene snovi, dodane topilu pri dani temperaturi, da nastane nasičena raztopina.
O koeficient topnosti se spreminja glede na pogoje in se lahko poveča ali zmanjša glede na spremembe temperature in zadevne raztopljene snovi.
Obstaja meja, do katere lahko topilo izvede raztapljanje.
Primer: Če sladkor daste v kozarec vode, boste prvič opazili, da sladkor v vodi izgine.
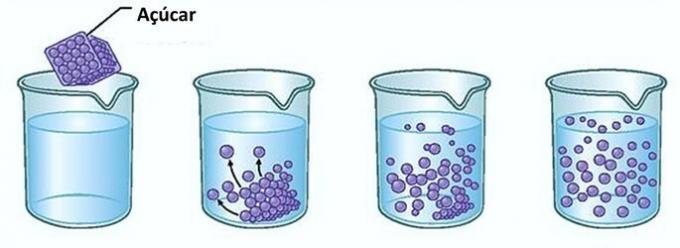
Če pa boste še naprej dodajali sladkor, boste ugotovili, da se bo v nekem trenutku začel kopičiti na dnu kozarca.
To je zato, ker je voda, ki je topilo, dosegla svojo mejo topnost in največjo količino koncentracije. Raztopljena snov, ki ostane na dnu posode in se ne raztopi, se imenuje telo ozadja.
Presežek sladkorja na dnu kozarca se ne bo raztopil in ne bo vplival na koncentracijo raztopine. Poleg tega sladkor, odložen na dnu kozarca, ne bo naredil slajše vode.
Klasifikacija rešitev
Raztopine lahko razvrstimo po količini raztopljene topljene snovi. Tako so lahko treh vrst: nasičene, nenasičene in prenasičene.
- nasičena raztopina: Raztopina je dosegla mejo koeficienta topnosti, to pomeni, da je v topilu pri določeni temperaturi raztopljena največja količina topljene snovi.
- nenasičena raztopina: Količina raztopljene raztopljene snovi še ni dosegla koeficienta topnosti. To pomeni, da lahko dodamo več topljene snovi.
- prenasičena raztopina: Raztopljene raztopljene snovi je več kot v običajnih pogojih. V tem primeru predstavljajo oborino.
Če želite izvedeti več o rešitvah, preberite naslednja besedila.:
- Razredčevanje raztopin
- Molalnost
- Molarnost
- Titracija
Koncentracija raztopin
Iz topljene snovi in topila je mogoče izračunati koncentracijo raztopine.
Skupna koncentracija je definirana kot razmerje med maso topljene snovi v dani prostornini raztopine.
Izračun koncentracije se izvede po naslednji formuli:
Biti,
Ç: Koncentracija (g / L);
m: masa topljene snovi (g);
V: prostornina raztopine (L).
Primer:
(Faap) Izračunajte koncentracijo vodne raztopine natrijevega nitrata v g / L v 30 g soli v 400 ml raztopine:
Resolucija:
Upoštevajte podatke o količinah topljene snovi in topila. V 400 ml vodne raztopine (topila) je 30 g soli (topljene snovi).
Vendar je prostornina v ml in jo moramo preoblikovati v L:
Če želite vedeti koncentracijo, morate uporabiti formulo:
S tem rezultatom smo prišli do zaključka, da ko zmešamo 30 g soli s 400 ml vode, dobimo raztopino s koncentracijo 75 g / L.
Za več informacij o izračunu skupne koncentracije bodo ta besedila v pomoč.:
- Koncentracija raztopine
- Vaje o skupni koncentraciji



