V besedilu "Razmerje med polarnostjo in topnostjo snovi" ste videli, da je to na splošno topljeno polarne snovi se raztopijo v topilih, ki so prav tako polarna in da se nepolarne snovi raztopijo tudi v topilih nepolarni. Vendar to ni pravilo, ki bi lahko veljalo za vse primere topnosti.
Na primer, sladkor se raztopi v vodi, olje pa ne. Res je, da sta molekuli vode in sladkorja polarni, medtem ko so molekule olja nepolarne, vendar so tipi medmolekularne sile med molekulami teh izoliranih snovi in med seboj, ki nam dajo razlago za to dejstvo.

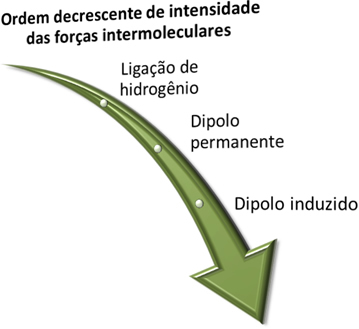
Preden ugotovimo, kakšne so te sile, se spomnite, da kot intenzivnost močnejša je vodikova vez, ki mu sledi stalna dipolna sila, najšibkejša pa je inducirana dipolna sila.
Tako molekule vode kot sladkorja (saharoza - C12H22O11), prisotni atomi kisika, vezani na atome vodika, tvorijo skupine ─ O ─ H. To pomeni da med molekulami vode in med molekulami sladkorja lahko pride do medmolekularnih interakcij vodikove vezi.
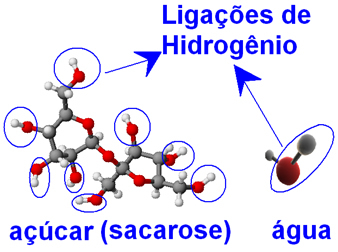
Zato molekule vode lahko zavijejo molekule sladkorja, ki so bile tesno povezane med seboj v obliki kristalov, in jih potegnejo narazen, kar preprečuje njihovo ponovno združitev. Tako je sladkor v vodi zelo topen in do 20 g ga lahko raztopimo v 100 g vode pri 20 ° C.
Zdaj se olje in voda ne mešata. To ne pomeni, da vode olje ne privlači, saj dejstvo, da se širi po površini vode, ne pa v obliki sferična, nam razkrije, da išče obliko, v kateri bi bila večja količina molekul olja v stiku z molekulami olja. Voda.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Vendar privlačnost med molekulami vode je veliko večja (vodikova vez) kot privlačnost med molekulami nafte in vode. Zato molekule olja ne morejo pretrgati vezi med dvema sosednjima molekulama vode.
Iz tega lahko sklepamo, da:
»Če je obstoječa medmolekularna sila močnejša od možne nove interakcije, se topljeno sredstvo ne raztopi, ostane prvotna vez. Če pa bo nova interakcija močnejša, se bo topljeno sredstvo raztopilo in porušilo medmolekularne vezi snovi. "
Drug primer, ki nam kaže na pomen medmolekularnih sil za topnost materialov, je, če imamo jod, vodo in benzen. V spodnjem diagramu imamo, da se jod dobro raztopi v benzenu in je v vodi rahlo topen, voda in benzen sta popolnoma se ne meša in ko imamo mešanico benzena in vode in nato dodamo jod, se ta raztopi le v benzen:
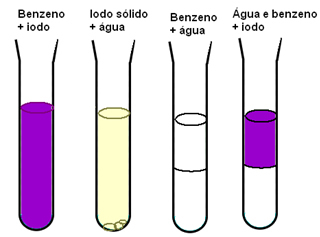
Benzen in jod sta nepolarna in se lažje mešata kot polarna voda. Toda tisto, kar se resnično pojasni, je, da so medmolekularno inducirane dipolne sile, ki obstajajo med nepolarnimi molekulami, šibke v primerjavi z vodikovimi vezmi vode.
Ker so obstoječe interakcije med molekulami vode močnejše od možnih, nove medsebojne interakcije se vodikove vezi ne pretrgajo in pri mešanju benzena in Voda.
Nove interakcije, ki nastanejo med molekulami joda in molekulami benzena, so intenzivnejše od tistih, ki se pojavijo med molekulami teh izoliranih snovi.
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Povezava med medmolekularno močjo in topnostjo snovi"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/relacao-entre-forca-intermolecular-solubilidade-das-substancias.htm. Dostop 27. junija 2021.