Izomerija gre za naravni pojav, pri katerem imajo različne snovi (glede kemijskih in fizikalnih lastnosti) popolnoma enako molekulsko formulo kot v naslednjem primeru:
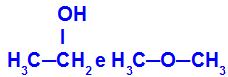
Različne snovi, ki imajo enako molekulsko formulo
Etanol (levo) ima molekulsko formulo C2H6O, ki se pojavlja tudi pri metoksietanu (desno), torej so izomeri.
Vrste izomerije
→ ploski izomer
Vrsta izomerije preučuje strukturne razlike med izomeri.
The) Poklic
Gre za vrsto ploščate izomerije, pri kateri razlika med snovmi temelji na razliki med organskimi funkcijami, ki jim pripadajo. Oglejte si nekaj primerov:
Propanon in propan:
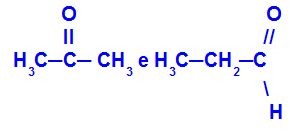
Izomeri, ki pripadajo različnim funkcijam
Propanon (levo) spada v skupino ketonov, propanal (desno) pa v skupino aldehidov.
B) Zapor
To je vrsta ploščate izomerije, pri kateri razlika med snovmi temelji na razliki med verigami, ki jih predstavljajo. Glej primer:
2-metil-propan in butan
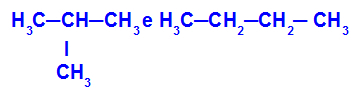
Izomeri, ki imajo verige z različnimi klasifikacijami
V primeru lahko vidimo, da ima 2-metil-propan (na levi) razvejano verigo, butan (na desni) pa normalno verigo.
ç) Položaj
To je vrsta ploščate izomerije, pri kateri razlika med snovmi temelji na razliki v položaju komponente, ki je prisotna v njihovih verigah. Glej primer:
1-kloro-propan in 2-kloro-propan
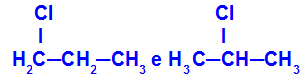
Izomeri, ki imajo komponente na različnih položajih v verigi
V primeru lahko vidimo, da ima 1-kloro-propan (na levi) klor nameščen na ogljiku 1, 2-kloro-propan (na desni) pa je klor na ogljiku 2.
d) Metamerija ali odškodnina
OPOMBA: Izomerija velja samo za heterogene strune.
To je vrsta ploščate izomerije, pri kateri razlika med snovmi temelji na razliki v položaju heteroatoma, ki je prisoten v njihovih verigah. Glej primer:
Primer: Metoksipropan in etoksietan
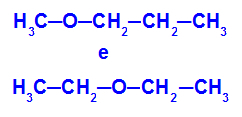
Izomeri, ki imajo heteroatome na različnih položajih v verigi
V primeru lahko vidimo, da ima kisik v metoksipropanu (levo) radikal z enim ogljikom na eni strani in tremi ogljiki na drugi strani. V etoksietanu (desno) ima kisik radikal z dvema ogljikoma na eni strani in dvema ogljikoma na drugi strani.
in)Tavtomerija
Gre za poseben primer izomerije ravninske funkcije in se pojavlja le v treh organskih funkcijah:
Aldehid
keton
Enol
Ta vrsta izomerije deluje na dejstvo, da med enolom in aldehidom ter med enolom in ketonom obstaja kemično ravnovesje, to pomeni, da se te komponente nenehno pretvarjajo druga v drugo. Glej primer:
Prop-2-en-1-ol in propanon
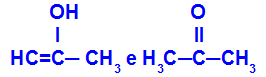
Izomeri, ki pripadajo različnim funkcijam
V primeru lahko vidimo, da Prop-2-en-1-ol (na levi) spada v skupino enolov, propanon (na desni) pa v skupino ketonov, torej so izomeri tavtomerije.
→ Vesoljska izomerija
Gre za vrsto izomerije, ki jo definira prostorska analiza molekule.
a) Geometrijski izomeri
Ne ustavi se zdaj... Po oglaševanju je še več;)
To je vrsta prostorske izomerije, ki se pojavi, ko ima snov molekule z naslednjimi značilnostmi:
Zaprta veriga z dvema ogljikoma z dvema različnima ligandoma, kot je v spodnjem primeru:

Zaprta struktura z geometrijsko izomerijo
Odprta veriga, ki ima dvojno vez med ogljiki, in v vsakem od teh ogljikov dvojne vezi sta dva različna liganda, kot v spodnjem primeru:
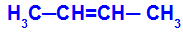
Odprta struktura z geometrijsko izomerijo
Geometrična izomerija je razdeljena na dve skupini:
1O Skupina: cis-trans
Pojavi se, kadar sta ligandi enega ogljika popolnoma enaka dvema ligandoma drugega ogljika, bodisi v odprti strukturi bodisi v zaprti strukturi.
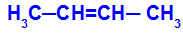
Veriga snovi, ki ima cis-trans izomerijo
Izomer se bo imenoval cis, ko bodo isti ligandi v isti ravnini.

Primer cis izomera
Izomer se bo imenoval trans, ko bodo različni ligandi v isti ravnini.

Primer trans izomera
2O Skupina: E-Z
Pojavi se, kadar sta ligandi enega ogljika različna glede na dva liganda drugega ogljika, bodisi v odprti strukturi bodisi v zaprti strukturi.

Veriga snovi, ki ima E-Z izomerijo
Izomer se bo imenoval E, če so ligandi z največjim atomskim številom v nasprotnih ravninah. V spodnjem primeru ima ogljik na levi Br z najvišjim atomskim številom (35), v drugem pa kisik (8).
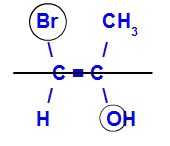
Primer E-izomera
Izomer se bo imenoval Z, ko bodo ligandi z največjim atomskim številom v isti ravnini. V spodnjem primeru ima ogljik na levi Br z najvišjim atomskim številom (35), v drugem pa kisik (8).

Primer Z-izomera
B) optični izomer
To je vrsta prostorske izomerije, ki se pojavi le, če ima snov molekule z kiralni ogljik (tisti, ki ima štiri različne ligande) v svojih strukturah. Molekula s kiralnim ogljikom ima sposobnost polarizacije in odbijanja svetlobe, kot sledi:
Desno (desni izomer)
Levo (vrtljivi izomer)
Spojina z optično aktivnostjo ima vedno aktivni izomeri (imenovani optični antipodi) in neaktivni izomeri (mešanica med dvema aktivnima izomeroma, mešanica, imenovana racemični).
Za določitev števila aktivnih (IOA) in neaktivnih (IOI) izomerov spojine s kiralnim ogljikom lahko uporabimo naslednjo formulo:
IOA = 2št
IOI = 2št
2
Spodaj je primer spojine, ki ima geometrijsko izomerijo:
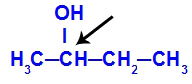
Kiralni ogljik v butan-2-olu
Struktura butan-2-ola ima naslednje ligande:
Metil (CH3)
Etil (CH3-CH2)
Vodik (H)
Hidroksil (OH)
Ker ima samo en kiralni ogljik, ima butan-2-ol:
Aktivni izomeri:
IOA = 21
IOA = 2
Neaktivni izomeri:
IOI = 21
2
IOI = 2
2
IOI = 1
Jaz, Diogo Lopes Dias
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Kaj je izomerija?"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Dostop 27. junija 2021.


