THE Kemična kinetika je področje, ki preučuje dejavnike, ki vplivajo na hitrost razvoja kemijskih reakcij, to je na hitrost njihovega poteka. O tem področju je vedno več raziskav, saj pogosto želimo pospešiti nekatere reakcije ali upočasniti druge. To je še posebej pomembno za industrijo in te raziskave imajo pomembne tehnološke posledice.
Ker pa se hitrost reakcije lahko spreminja v vsakem časovnem intervalu in od ene snovi do druge, je običajno izračunati povprečna hitrost reakcije.
Razmislite o naslednji splošni reakciji, pri kateri so koeficienti male črke, reaktanti in proizvodi pa velike črke:
a A + b B → c C + d D
Podana bo povprečna hitrost te reakcije delitev povprečne hitrosti reakcije katere koli reakcijske snovi ali povprečne hitrosti tvorjenja katerega koli proizvoda s pripadajočim koeficientom v kemijski enačbi. To podaja:
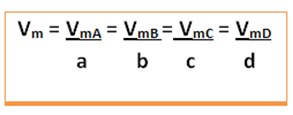
Na primer, razmislite o reakciji razgradnje vodikovega peroksida:
2 uri2O2 (aq) → 2 H2O(1) + 1 O2 (g)
Recimo, da je v 1 minuti nastalo 0,3 mol / L H2O in 0,15 mol / L O
2, medtem ko se 0,3 mol / L H razgradi2O2, to pomeni, da so povprečne hitrosti razgradnje in tvorbe teh snovi v reakciji:VmH202 = 0,3 mol / l. min
VmH20 = 0,3 mol / l. min
VmO2 = 0,15 mol / l. min
Povprečno hitrost globalne reakcije bomo našli tako, da vzamemo eno od teh vrednosti in jo delimo z ustreznim koeficientom v enačbi:
Vm = VmH202 = 0,3 mol / l. min = 0,15 mol / l. min
2 2
Vm = VmH20 = 0,3 mol / l. min = 0,15 mol / l. min
2 2
Vm = VmO2 = 0,15 mol / l. min = 0,15 mol / l. min
1 1
Upoštevajte, da so tri vrednosti enake, zato je hitrost reakcije enaka kot kateri koli reaktant ali produkt v istem časovnem intervalu.
Kako pa so bile ugotovljene vrednosti povprečnih hitrosti vsake snovi, ki sodeluje v teh reakcijah?
Lahko se izračuna delitev spremembe koncentracije snovi (reagenta ali proizvoda) s časovnim intervalom. Če bomo določili povprečno hitrost enega od reagenti reakcije, bomo morali postaviti negativni znak pred ali pa upoštevajte vrednost koncentracije v modulu ||, ker bi koncentracija reaktanta sčasoma upadala, bi bila vrednost hitrosti negativna, negativne hitrosti pa ni.
Ne ustavi se zdaj... Po oglaševanju je še več;)

Na primer, razmislite o naslednji reakciji razgradnje ozonskih plinov (O3 (g)) v kisikovem plinu (O2 (g)):
2 O3 (g) → 3 O.2 (g)
Recimo, da je bilo v balonu 10 molov ozonskega plina, a po 1 minuti so ostali le 4 moli; to pomeni, da se je 6 molov ozona spremenilo v plin kisika. Torej imamo:
2 O3 (g) → 3 O.2 (g)
t = 0 min 2 mol / L 0 mol / L
nastali odhodki
6 mol / l 9 mol / l
t = 1 min 4 mol / L 9 mol / L
Upoštevajte, da ker je reakcijsko razmerje 2: 3, potem če bi uporabili 6 molov O3, Nastalo je 9 mol O2. Tako imamo po 1 minuti naslednje povprečne hitrosti:
Vm = - ∆ [The3]
t
Vm = - ([O3finale - O3inicialen])
tKončno - tzačetno
Vm = - ([4 - 10])
1– 0
Vm = 6 mol / l. min→ 1 minuto je v vsakem litru sistema reagiralo 6 mol ozona.
Vm = ∆ [The2]
t
Vm = ([O2finale - O2inicial])
tKončno - tzačetno
Vm = ([9 - 0])
1– 0
Vm = 9 mol / l. min→ V 1 minuti je v vsakem litru sistema nastalo 9 molov kisika.
To nam kaže, da lahko izračunamo povprečno hitrost v odvisnosti od reaktantov ali v odvisnosti od produktov.
Zdaj, če želimo izračunati povprečno hitrost te globalne reakcije, naredimo tako, kot smo pokazali na začetku: vsako od teh hitrosti delimo s svojimi koeficienti v kemijski enačbi:
Vm = VmO3 = 6 mol / l. min = 3 mol / l. min
2 21
Vm = VmO2 = 9 mol / l. min = 3 mol / l. min
3 3
Vm = VmO3 = VmO2
23
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Hitrost kemičnih reakcij"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm. Dostop 27. junija 2021.