Elektroliza je fizikalno-kemijski postopek, ki uporablja električno energijo iz katerega koli vira (npr baterijo ali baterija), da se v kemijski reakciji prisili, da nastanejo enostavne ali sestavljene snovi, ki jih v naravi ni mogoče najti ali jih ni v velikih količinah.
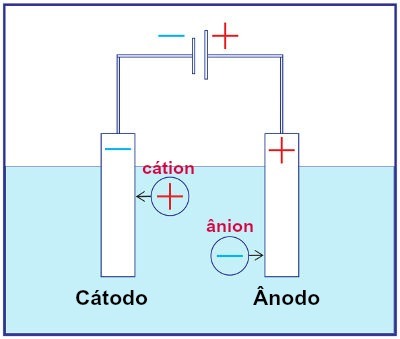
Prikaz sklopa katerega koli elektroliznega sistema
Med elektrolizo se kation na katodi reducira, anion pa na anodi. To se zgodi zaradi električnega praznjenja, ki ga zagotavlja zunanji vir. Tako imamo pri elektrolizi ne-spontano reakcijo oksidacije in redukcije.
Zdaj pa razumejte dva načina, na katere pride do elektrolize:
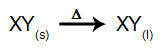
Pri tej vrsti elektrolize uporabljamo a ionska snov v tekočem stanju v elektrolitski kadi. Ko je ionska snov (XY) podvržena fuziji, je podvržena postopku disocijacija, kot je predstavljeno spodaj:

Potem, ko je vir energije vklopljen, kation (X+) se premakne proti katodi, anioni (Y-) premaknite se proti anodi. S tem:
Na katodi: kationi sprejmejo elektrone (podvržejo se redukciji) in se pretvorijo v stabilno snov (X), postopek je predstavljen z naslednjo enačbo:
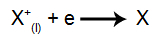
Na anodi: anioni izgubijo elektrone (preidejo v oksidacijo) in postanejo stabilna snov (X), postopek, ki ga predstavlja naslednja enačba:

a) Primer magmatske elektrolize
Kot primer lahko zdaj sledimo magmatski elektrolizi natrijev klorid (NaCl). Ko se natrijev klorid (NaCl) podvrže fuziji, se izvede postopek disociacije, kot je prikazano spodaj:
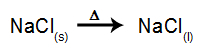
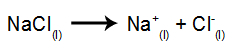
Potem, ko je vir energije vklopljen, kation (Na+) se premakne proti katodi, anioni (Cl-) premaknite se proti anodi. S tem:
Na katodi: kationi v+ prejmejo elektrone (podvržejo se redukciji) in postanejo stabilna snov (Na, ki je trdna kovina), postopek, ki ga predstavlja spodnja enačba:

Na anodi: Cl anioni- izgubijo elektrone (preidejo v oksidacijo) in postanejo stabilna snov (Cl2, ki je plinast), postopek, predstavljen s spodnjo enačbo:

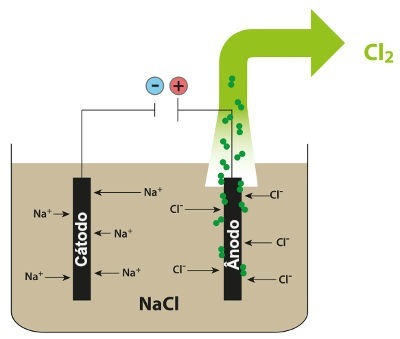
Shema, ki prikazuje magmatsko elektrolizo NaCl
Tako pri magmatski elektrolizi natrijevega klorida tvorimo kovinski natrij (Na) in plin v kloru (Cl2).
Pri tej vrsti elektrolize uporabljamo ionsko snov, raztopljeno v vodi, znotraj elektrolitskega rezervoarja. Torej, preden opravimo elektrolizo, najprej zmešamo snov (običajno sol anorganski) v vodi, da povzroči njeno disociacijo (sproščanje kationa in aniona), kot je prikazano spodaj:
Ne ustavi se zdaj... Po oglaševanju je še več;)
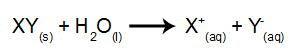
Razlika v zvezi z magmatsko elektrolizo je v tem, da imamo poleg ionov iz disociacije tudi ione iz samoionizacije vode. V svoji samoionizaciji voda tvori hidronijev kation (H+) in hidroksid anion (OH-), kot v spodnji enačbi:

Tako imamo znotraj elektrolitske kadi prisotna dva kationa (enega iz snovi ionski in eden iz vode) in dva aniona (eden iz ionske snovi in drugi iz Voda).
Da bi vedeli, kateri kation se bo premaknil na katodo in kateri anion se bo premaknil na anodo, je treba poznati vrstni red odvajanja kationov in anionov.
Za katione:
Au> Pt> Hg> Ag> Cu> Ni> Cd> Pb> Fe> Zn> Mn> hidronij> Družina IIIA> Družina IIA> Družina IA
za anione
Neoksigenirani anioni in HSO4 > hidroksid> kisikovi anioni in F
Potem, ko je vir energije vklopljen, kation (X+) se premakne proti katodi in eden od anionov (Y-) se premakne proti anodi.
Na katodi: kationi sprejmejo elektrone (podvržejo se redukciji) in se pretvorijo v stabilno snov (X), postopek, ki ga predstavlja spodnja enačba:

Na anodi: anioni izgubijo elektrone (preidejo v oksidacijo) in se spremenijo v stabilno snov (Y), postopek, ki ga predstavlja spodnja enačba:
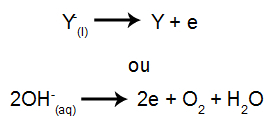
a) Primer vodne elektrolize
Kot primer bomo uporabili vodno elektrolizo natrijevega klorida (NaCl). Ko se natrijev klorid (NaCl) raztopi v vodi, se izvede postopek disociacije, kot je prikazano spodaj:
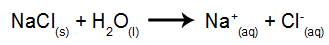
Poleg disociacije NaCl imamo še samoionizacijo vode:

Torej imamo H katione+ in naprej+ in OH anioni- in Cl-. Potem, ko je vir napajanja vklopljen, imamo naslednje:
na katodi: H kationi+ sprejemajo elektrone (zmanjšane) in postanejo stabilna snov (H2, ki je plin). To je zato, ker ima hidronij prednost pred izpusti pred elementi iz družine IA (v tem primeru Na). Postopek predstavlja spodnja enačba:
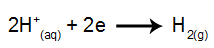
na anodi: anioni Cl- izgubijo elektrone (preidejo v oksidacijo) in postanejo stabilna snov (Cl2, ki je plinast). To je zato, ker Cl- je anoksirani anion in ima prednost pred izpuščanjem pred hidroksidom, postopek, ki ga predstavlja spodnja enačba:


Shema, ki prikazuje vodno elektrolizo NaCl
Tako imamo pri vodni elektrolizi natrijevega klorida tvorbo vodikovega plina (H2) in klorov plin (Cl2).
Jaz, Diogo Lopes Dias
Kemija

Uporaba elektrolize, galvanizacije, nikljanja, kromiranja, niklja, kroma, katode, natrija, aluminija, klora, kavstična soda, vodikov plin, magmatska elektroliza, vodna elektroliza, alkalne kovine, zemeljska alkalija, plin klor.