Ko govorimo o pH, se sklicujemo na vodikov potencial raztopine, to je na količino hidronijevih kationov (H+ ali H3O+), ki se razpršijo v topilu raztopine.
Katoni hidronija so dobro znani zaradi definicije, ki jo je predlagal znanstvenik Arhenije za kislino. Ta znanstvenik to trdi kislina je zmožna vsaka snov ionizirajo in proizvajajo hidronijeve ione v vodnem mediju.
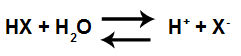
Enačba kislinske ionizacije
kratica pH služi kot referenca za določanje stopnje kislosti medija. Toda kemiki so jo dolgo uporabljali tudi kemiki pH kot referenca, da se poleg kislosti določi, ali je medij bazičen ali nevtralen.
To je mogoče, ker se kemiki zdaj zavedajo, da se voda samoionizira, to pomeni, da proizvaja hidronije (H+) in hidroksidi (OH-). Tako vodna raztopina nikoli nima samo hidronija ali hidroksida, ampak oboje, kot lahko vidimo iz naslednje enačbe:

Enačba avtoionizacije vode
Vrednosti, uporabljene kot referenca za pH
Vrednosti, uporabljene za pH se nanašajo na ionizacijsko konstanto (Kw) vode pri temperaturi 25OC, kar je enako 10
-14. Pri tej temperaturi so koncentracije hidronijevih in hidroksidnih ionov, ki jih proizvaja voda, popolnoma enake, to je 10-7 mol / L.[H+] = [OH-]= 10-7
V tej referenci se vrednosti pH uporabljajo od 0 do 14.
Formule za izračun pH
a) Izračun iz koncentracije hidronijevih kationov v mol / L
Izračun vrednosti pH lahko opravimo neposredno, če poznamo koncentracijo hidronijev ([H+]). Poglej:
pH = -log [H+]
ali
10-pH = [H+]
b) Izračun iz koncentracije hidroksidnih anionov (OH-)
pOH = -log [OH-]
ali
10-pOH = [OH-]
Po izračunu vrednosti pOH jo morate uporabiti v naslednjem izrazu za določitev vrednosti pH.
pH + pOH = 14
Interpretacija vrednosti pH
Če poznamo vrednost pH, lahko ugotovimo, ali ima zadevna raztopina kisel, bazičen ali nevtralen značaj. Če želite to narediti, uporabite naslednjo shematsko povezavo:
Za vrednosti pH pod 7 = kisli medij;
Za pH z vrednostjo 7 = nevtralni medij;
Za vrednosti pH nad 7 = osnovni medij.
Primeri
1. primer: Če vemo, da je koncentracija hidronijevih kationov v raztopini 2,10-4 mol / L, kakšna naj bo pH vrednost te raztopine?
Za določitev pH vrednosti raztopine iz koncentracije hidronijev (H+), 2.10-4 mol / L, uporabiti moramo naslednji izraz:
pH = -log [H+]
pH = -log [2.10-4 ]
pH = - (log 2 + log 10-4)
pH = -log2 - log10-4
pH = –dnevnik 2 - 4.log 10
pH = –0,3 + 4. (1)
pH = -0,3 + 4
pH = 3,7
2. primer: Raztopina, ki jo tvori določena topljena snov, ima koncentracijo hidroksidnih ionov 10-11 mol / L. Iz te koncentracije lahko rečemo, da je pH te raztopine vreden koliko?
Za določitev vrednosti pH raztopine iz koncentracije hidroksida, 10-11 mol / L, moramo narediti naslednje:
1O Korak: izračunajte vrednost pOH.
10-pOH = [OH-]
10-pOH = 10-11
Izraz moramo pomnožiti z -1, ker je pOH vedno pozitivna neznanka.
-pOH = -11. (- 1)
pOH = 11
2O Korak: izračunajte vrednost pH.
pH + pOH = 14
pH + 11 = 14
pH = 14 - 11
pH = 3
Jaz, Diogo Lopes Dias
Vir: Brazilska šola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ph.htm