Vprašanja o kemijske bilance v Enem se zelo ponavljajo. S tem namenom smo ustvarili to gradivo, ki prinaša najpomembnejše teme o tej veji fizikalne kemije, zajete v nacionalnem srednješolskem izpitu (Enem).
Med vprašanji, povezanimi s kemijskim ravnotežjem, imamo ravnotežno konstanto glede koncentracije v mol / l in tlaka, ionska ravnotežna konstanta, ionizacijska konstanta, ravnotežni premik, pH in pOH, konstanta hidrolize, pufer in konstanta topnost.
Med zgoraj opisanimi predmeti imajo nekateri od njih večjo prepoznavnost pri Enemu:
Premik ravnotežja
Ionizacijska konstanta
pH
slana hidroliza
Video lekcija o kemijski tehtnici pri Enem
1. Premik ravnotežja v Enem
1.1- (Enem 2015) Hipoksija ali bolezen višine je sestavljena iz zmanjšanega kisika (O2) v arterijski krvi telesa. Iz tega razloga mnogi športniki doživljajo nelagodje (glavoboli, omotica, zasoplost) pri izvajanju telesne dejavnosti na visoki nadmorski višini. V teh pogojih se bo koncentracija kisika hemoglobina (HbO2) v ravnovesju v krvi, glede na razmerje:
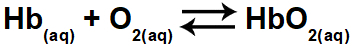
Sprememba koncentracije oksigeniranega hemoglobina v krvi nastane zaradi:
a) zvišanje krvnega tlaka.
b) zvišanje telesne temperature.
c) zniževanje temperature okolja.
d) padec parcialnega tlaka kisika.
e) zmanjšanje količine rdečih krvnih celic.
Oksigeniran hemoglobin (HbO2) najdemo v reaktantih (desna stran) enačbe. Vadba sprašuje, katera od možnosti bi privedla do spremembe kisikovega hemoglobina v krvi, torej bi premaknila ravnovesje v levo ali v desno.
a) Napačno. Povečan pretok krvi nima nič skupnega s povišanim krvnim tlakom.
b) Napačno. Temperatura ne spremeni ravnotežja.
c) Napačno. Temperatura ne spremeni ravnotežja.
d) Resnično. Zmanjšanje parcialnega tlaka kisika zmanjša količino oksigeniranega hemoglobina in premakne ravnovesje v levo.
e) Napačno. Padec števila rdečih krvnih celic bo povzročil padec števila hemoglobinov in oksigeniranih hemoglobinov.
1.2- (Enem 2011) Brezalkoholne pijače postajajo vedno bolj tarča politik javnega zdravja. Izdelki iz lepila vsebujejo fosforno kislino, snov, ki je škodljiva za fiksacijo kalcija, minerala, ki je glavna sestavina zobnega matriksa. Karies je dinamičen proces neravnovesja v procesu demineralizacije zob, izguba mineralov zaradi kislosti. Znano je, da je glavna sestavina zobne sklenine sol, imenovana hidroksiapatit. Soda s prisotnostjo saharoze zmanjša pH biofilma (bakterijski plak), kar povzroči demineralizacijo zobne sklenine. Mehanizmi obrambe sline trajajo od 20 minut do 30 minut, da normalizirajo raven pH in znova remineralizirajo zob. Naslednja kemijska enačba predstavlja ta postopek:

Glede na to, da oseba dnevno uživa brezalkoholne pijače, lahko pride do zobne demineralizacije zaradi povečane koncentracije:
a) OH-, ki reagira s Ca ioni2+, premikanje ravnotežja v desno.
b) H+, ki reagira z OH hidroksili-, premikanje ravnotežja v desno.
c) OH-, ki reagira s Ca ioni2+, premikanje ravnotežja v levo.
d) H+, ki reagira z OH hidroksili-, premikanje ravnotežja v levo.
e) Ca2+, ki reagira z OH hidroksili-, premikanje ravnotežja v levo.
Pravi odgovor: Črka B
Resolucija
Postopek demineralizacije premakne ravnovesje v desno. Ko oseba pije sodo, zaužije kislo snov, to pomeni, da poveča količino H+ v sredini. H+ hitro komunicira z OH- ravnotežja, zmanjšanje količine OH-. Na ta način se ravnotežje premakne v desno in demineralizira zob.
1.3- (Enem-2013) Eden od korakov pri čiščenju vode je razkuževanje, pri čemer je najpogosteje uporabljena metoda kloriranja. Ta metoda sestoji iz raztapljanja klorovega plina v raztopini pod pritiskom in nanosa na vodo, ki jo je treba razkužiti. Enačbe kemijske reakcije so:

Dezinfekcijsko delovanje nadzira hipoklorova kislina, ki ima približno 80-krat večji razkuževalni potencial od hipokloritnega aniona. PH medija je pomemben, ker vpliva na to, v kolikšni meri se klorovodikova kislina ionizira. Da bo razkuževanje učinkovitejše, mora biti pH vode, ki jo je treba obdelati, bližje:
a) 0
b) 5
c) 7
d) 9
e) 14
Pravi odgovor: Črka B
Glede na besedilo najbolje razkužilo deluje snov HClO. Zato mora biti vsaka razlaga in sklep usmerjena v način pridobivanja te snovi.
Snov HClO je prisotna v drugem ravnotežju, zato je zanimiva taktika premik tega ravnovesja v levo. Za to je v skladu s načelo Le Chatelierja, imamo možnost povečati količino H+ (dodajanje kisle snovi, pH manj kot 7) ali povečanje količine Cl-.
Omeniti velja, da je v prvi enačbi še eno kemijsko ravnovesje, ki predstavlja vrste HClO-, ki ima sorodnost s H+, premikanje ravnotežja v levo. To je poteza, ki je ne želimo.
Zato moramo uporabiti kisli pH (pod 7). Vendar ta pH ne bi smel biti preveč kisel, da bi se izognili številnim kationom H.+ v sredini.
Glej tudi:Kemijsko ravnovesje v jamah
2. pH in hidroliza soli v Enem
2.1- (Enem-2017) Iz postopka ekstrakcije lahko iz rastlin pridobimo več naravnih proizvodov. Lapachol spada v razred naftokinona. Njegova struktura ima enol hidroksil (pKa = 6,0), ki omogoča izolacijo te spojine iz ipe žagovine z ekstrakcijo z ustrezno raztopino, čemur sledi preprosto filtriranje. Upoštevajte, da je pKa = -log Ka in da je Ka kisla konstanta ionizacijske reakcije lapachol.

Katero raztopino je treba uporabiti za učinkovitejše pridobivanje lapahola iz žagovine ipê?
a) raztopina Na2CO3 da nastane sol lapahola.
b) Raztopina pufra ocetne kisline / natrijevega acetata (pH = 4,5).
c) raztopina NaCI za povečanje ionske jakosti medija.
d) raztopina Na2SAMO4 da tvorimo ionski par z lapacholom.
e) raztopina HCI, da jo ekstrahiramo s kislinsko-bazično reakcijo.
Izjava navaja, da je pKa snovi 6,0. V izrazu pKa je treba uporabiti to vrednost pKa:
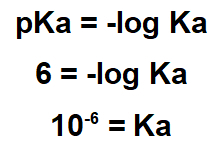
Ker je vaš Ka majhen, je lapachol kisla snov, zato ga je koristno uporabiti z osnovno snovjo.
a) Resnično. Sol je osnovna, saj prihaja iz močne baze (ker je iz družine IA) in CO3 prihaja iz šibke kisline (H2CO3).
b) Napačno. Puferska raztopina je kisla in potrebujemo bazo.
c) Napačno. NaCl je nevtralna sol, saj prihaja iz močne baze (ker je iz družine IA), Cl pa iz močne kisline (HCl).
d) Napačno. Ob2SAMO4 je nevtralna sol, saj Na prihaja iz močne baze (ker je iz družine IA) in SO4 prihaja iz močne kisline (H2SAMO4).
to je ponaredek. HCl je kislina in potrebujemo bazo.
2.2- (Enem-2014) Da bi čim bolj zmanjšali vplive na okolje, brazilska zakonodaja določa, da imajo kemični ostanki, ki se sproščajo neposredno v sprejemno telo, pH med 5,0 in 9,0. V vodnih tekočih odpadkih, ki nastanejo v industrijskem postopku, je koncentracija hidroksilnih ionov 1,0,10-10 mol / L. V skladu z zakonodajo je kemik ločil naslednje snovi, ki so na voljo v skladišču podjetja: CH3COOH, Na2SO4, CH3OH, K2CO3 in NH4Kl.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Katero snov bi lahko uporabili za uravnavanje pH, da se ostanek spusti neposredno v telo prejemnika?
a) CH3COOH
b) V2SAMO4
c) CH3oh
d) K2CO3
e) NH4Kl
Pravi odgovor: Črka D
Resolucija
Korak 1: Določite pH ostanka.
Vaja kaže, da ima ostanek koncentracijo hidroksida 10-10.
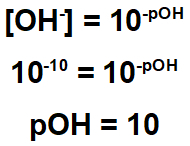
Zato lahko izračunamo pH tega ostanka:

Iz zgoraj navedenega ugotovimo, da ima ostanek kislinski značaj, saj je njegov pH manjši od 7. Za njeno nevtralizacijo je torej treba uporabiti snov osnovnega značaja.
2. korak: Določite značaj vsake soli, da označite, katera je osnovna, kot CH3COOH (alternativa a) je kislina in CH3OH (alternativa c) je alkohol, organski razred s kislim značajem.
b) nevtralna sol, saj Na prihaja iz močne baze (ker je iz družine IA) in SO4 prihaja iz močne kisline (H2SAMO4).
d) Osnovna sol, saj K prihaja iz močne baze (ker je iz družine IA) in CO3 prihaja iz šibke kisline (H2CO3).
e) kisla sol kot NH4 prihaja iz šibke baze (NH4OH) in Cl prihaja iz močne kisline (HCl).
2.3- (Enem-2014) Raziskovalec opazi, da je nalepka na enem od kozarcev, v katerem hrani koncentrat prebavnih encimov, neberljiva. Ne ve, kateri encim vsebuje kozarec, vendar sumi, da gre za želodčno proteazo, ki v prebavi beljakovin deluje v želodcu. Ker ve, da je prebava v želodcu kisla in črevesje osnovno, sestavi pet epruvet s hrano drugačno, dodajte encimski koncentrat raztopinam z določenim pH in počakajte, da vidite, ali encim deluje v katerem koli njihovi. Epruveta, v kateri mora encim delovati, da pokaže, da je raziskovalčeva hipoteza pravilna, je tista, ki vsebuje:
a) krompirjeva kocka v raztopini s pH = 9.
b) kos mesa v raztopini s pH = 5.
c) kuhan jajčni beljak v raztopini s pH = 9.
d) del rezancev v raztopini s pH = 5.
e) maslena kroglica v raztopini s pH = 9.
Pravi odgovor: Črka B
Vaja od študenta zahteva dobro razlago in korelacijo z biokemijskim znanjem živil. Sporoči, da raziskovalec meni, da je encim prebavni, deluje pri kislem pH in deluje na beljakovine (ker je proteaza).
Če ta encim deluje v kislem okolju, mora biti pH manjši od 7. Meso je sestavljeno iz beljakovin, testenine pa iz ogljikovih hidratov. Pravi odgovor je torej alternativa b.
2.4- (Enem- 2012) Gospodinja je zaradi odmrzovanja rib v hladilniku po naključju spustila vodo, ki je pustila močan in neprijeten vonj v napravi. Znano je, da je značilen vonj rib zaradi aminov in da se te spojine obnašajo kot osnove. V tabeli so navedene koncentracije vodika nekaterih materialov, ki jih najdemo v kuhinji, na katere gospodinja razmišlja, da bi jih uporabila pri čiščenju hladilnika.

Kateri izmed naštetih materialov je primeren za lajšanje tega vonja?
a) Alkohol ali milo
b) Limonin sok ali alkohol
c) Limonin sok ali kis
d) Limonin sok, mleko ali milo
e) Milo ali soda / soda pepel
Pravi odgovor: Črka C
Resolucija
Vaja predlaga težavno situacijo, v kateri ima hladilnik gospodinje močan vonj, ki ga povzroča osnovna snov. Tako se sprašuje, kateri materiali bi bili zanimivi za rešitev tega problema.
Za nevtralizacijo baze je treba uporabiti material kisle narave ali s pH nižjim od 7. Kako so vaje zagotavljale vrednosti koncentracij H+ materialov je bilo dovolj, da smo uporabili vsakega v spodnjem izrazu:

Tako:
Sok: pH = 2
Mleko: pH = 6
Kis: pH = 3
Alkohol: pH = 8
Milo: pH = 12
Sod: pH = 12
Materiali s kislim značajem so sok, kis in mleko. Tako le alternativa c prinaša snovi kisle narave.
3. Konstanta ravnotežja v Enem
3.1- (Enem-2016) Po popolni obrabi lahko pnevmatike zgorete za proizvodnjo električne energije. Med plini, ki nastanejo pri popolnem zgorevanju vulkanizirane gume, je nekaj onesnaževal in povzročajo kisli dež. Da jim preprečimo uhajanje v ozračje, lahko te pline prepihamo v vodno raztopino, ki vsebuje primerno snov. Upoštevajte informacije o snovi, navedene v spodnji tabeli:

Med snovmi, navedenimi v tabeli, je tista, ki lahko najučinkoviteje odstrani onesnaževalne pline (a)
a) fenol.
b) piridin.
c) metilamin.
d) kalijev hidrogenfosfat.
e) kalijev hidrogen sulfat.
Pravi odgovor: Črka D
Resolucija
Vaja predstavlja problematično situacijo, v kateri onesnažujoči plini spodbujajo kisli dež. Nato vpraša, katera od omenjenih snovi bi bila zanimiva za nevtralizacijo teh plinov in posledično izogibanje kislemu dežju.
Da bi se izognili kislemu dežju, je treba kislinske pline nevtralizirati z uporabo osnovne raztopine. Snovi s to značilnostjo so tiste, ki prednostno sproščajo skupine OH- v sredini. V tabeli so piridin, metilamin in kalijev hidrogenfosfat osnovne snovi.
Da bi torej ugotovili snov, ki lahko učinkoviteje odstranjuje onesnaževalne pline, moramo analizirati vrednost ionizacijske konstante. Večja kot je konstanta, večja je sposobnost sproščanja OH-. Torej kalijev hidrogenfosfat je v tem primeru najprimernejša snov.
3.2- (Enem-2015) Številne kisline se uporabljajo v industrijah, ki odplake odlagajo v vodna telesa, kot so reke in jezera, kar lahko vpliva na okoljsko ravnovesje. Za nevtralizacijo kislosti lahko odtoku v ustreznih količinah dodamo sol kalcijevega karbonata, saj tvori bikarbonat, ki nevtralizira vodo. Predstavljene so enačbe, vključene v postopek:

Na podlagi vrednosti ravnotežnih konstant reakcij II, III in IV pri 25O C, kolikšna je številčna vrednost ravnotežne konstante reakcije I?
a) 4,5x10-26
b) 5x10-5
c) 0,8x10-9
d) 0,2x105
e) 2,2x1026
Pravi odgovor: Črka B
Resolucija
Ta vaja vključuje stalno ionizacijo. Sprva je nujno razumeti, da je enačba I dejansko rezultat (vsota) enačb II, III in IV. Zato moramo za začetek resolucije uporabiti načela hessov zakon.
Korak 1: Uporaba Hessovega zakona.
Če obrnemo enačbo II in vodimo enačbi III in IV, imamo:
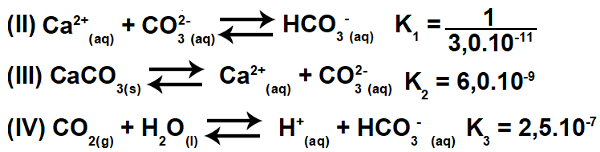
Tako lahko opazimo, da anion CO3-2 in kation H+ bo izločena, vsota enačb pa bo imela za posledico enačbo I.
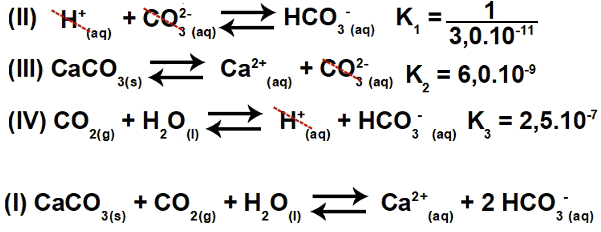
2. korak: stalni izračun
Konstanta ravnotežja ionizacijske enačbe je vedno podana z množenjem konstant drugih enačb:

Jaz, Diogo Dias


