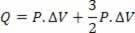V izovolumetričnih procesih količina ostane konstantna, zato se ne izvaja nobeno delo. Toplota, ki se izmenjuje z medijem, je enaka spremembi notranje energije sistema (glej tabelo zgoraj).
Po prvem termodinamičnem zakonu v katerem koli termodinamičnem procesu količina toplote V sistem, enak delu, ki ga opravi, plus sprememba njegove notranje energije. Zato enačba, ki predstavlja prvi zakon, sledi spodaj:
Q = τ + ∆U
Kot je navedeno v prvem odstavku, kjer piše, da dela ni, moramo τ=0. Tako je izmenjava toplote z medijem enaka povečanju notranje energije sistema. Tako imamo:
Ne ustavi se zdaj... Po oglaševanju je še več;)
Q = ∆U
Ko se v sistem dovaja toplota, torej kdaj V je pozitivna, se bo notranja energija povečala; in ko sistem izgubi toploto, torej kdaj V negativna, se bo notranja energija zmanjšala. Postopki s konstantno prostornino se pojavijo, ko je posoda, ki vsebuje material, toga (npr. Plinska jeklenka).
Ko se toplota prejema, se sistem nagiba k širjenju, vendar ga ovirajo stene posod, zato se tlak in temperatura sistema povečujeta.
Avtor Domitiano Marques
Diplomiral iz fizike
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
SILVA, Domitiano Correa Marques da. "Prvi zakon za izovolumetrične procese"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isovolumetricos.htm. Dostop 27. junija 2021.