Po prvem termodinamičnem zakonu v katerem koli termodinamičnem procesu količina toplote V sistem, enak delu, ki ga opravi, plus sprememba njegove notranje energije.
Kadar je tlak konstanten, se toplota, ki jo sistem izmenjuje z zunanjim medijem, uporablja za delo in za spreminjanje notranje energije. V mnogih praktičnih situacijah so sistemi podvrženi atmosferskemu tlaku, kot v primeru kemične reakcije. Zgornja slika prikazuje PV-diagram te vrste postopka.
V tem primeru je v enačbi prvega zakona
Q = τ + ∆U
noben izraz ni nič. Delo je napisano kot funkcija spreminjanja prostornine V, kot so:
τ = P.∆V
Za poseben primer idealnega monoatomskega plina lahko energijo zapišemo na naslednji način:
Ne ustavi se zdaj... Po oglaševanju je še več;)

Zato lahko zapišemo prvi zakon termodinamike kot funkcijo ΔV:


Toplota, ki se izmenjuje z medijem, je (5/2) P.ΔV, in 40% celotne količine - kar ustreza P.ΔV - se porabi za delo; in (3/2) P.ΔV, kar ustreza 60% celotne vrednosti, se uporabljata za spreminjanje notranje energije. Ta rezultat velja za idealen monoatomski plin.
Toplota je povezana s temperaturnimi nihanji (z uporabo zakona o idealnem plinu) z:
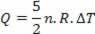
Tako lahko dovedeno toploto izračunamo s spremembo temperature ali s spremembo prostornine.
Avtor Domitiano Marques
Diplomiral iz fizike
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
SILVA, Domitiano Correa Marques da. "Prvi zakon za izobarne procese"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isobaricos.htm. Dostop 27. junija 2021.