Energieinterné je súčet kinetické energie a potenciál súvisiaci s pohybom základných atómov a molekúl tela. Vnútorná energia je tiež priamo úmerná teplota tela. Je to skalárna veličina meraná v Jouloch (SI) a určená ako funkcia premenných ako napr tlak (P), objem (V) a teplota termodynamika (T) systému v Kelvinoch (K).
Čím vyššia je teplota tela, tým väčšia je jeho vnútorná energia, tým väčšia je schopnosť vykonávať určitú prácu. Ďalej je napríklad vnútorná energia jednoatómových plynov daná výlučne súčtom Kinetická energia každého atómu plynu. Pri práci s molekulárnymi plynmi, ako sú napr. Kremeliny, je potrebné brať do úvahy molekulárne interakcie a napr toto, vnútorná energia je určená súčtom kinetickej energie molekúl s potenciálnou energiou existujúcou medzi oni.
Teraz neprestávajte... Po reklame je toho viac;)
Vnútorná energia ideálnych jednoatómových plynov
Pretože nedochádza k interakcii medzi atómami ideálneho jednoatómového plynu, jeho vnútorná energia závisí výlučne od dvoch premenných: počtu mólov (n) a teploty plynu (T). Pozerať:
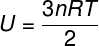
U - vnútorná energia
č - počet krtkov
R - univerzálna konštanta dokonalých plynov
T - teplota
Vo vyššie uvedenej rovnici R má modul 0,082 atm. L / mol. K alebo 8,31 J / mol. K (SI). Vyššie uvedenú rovnicu môžeme tiež napísať z hľadiska ďalších veličín, napríklad tlaku a objemu. Z tohto dôvodu si musíme uvedomiť Clapeyronova rovnica, používané pre ideálne plyny.
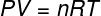
Keď vyššie uvedenú rovnicu nahradíme predchádzajúcou, pre výpočet vnútornej energie budeme mať nasledujúci výraz:
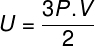
Pozritiež:Čo je to dokonalý plyn?
Ak vezmeme do úvahy vyššie uvedené rovnice, je možné určiť vzťah medzi kinetickou energiou atómov ideálneho jednoatómového plynu a jeho teplotou. Za týmto účelom uvedieme, že kinetická energia tohto typu plynu je čistokinetika. Pozerať:
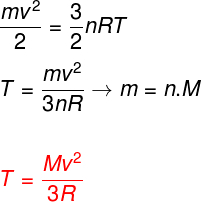
m - cestoviny
č - krtkové číslo
M - molárna hmota
V mnohých situáciách je zaujímavé vedieť, ako vypočítať variáciu vnútornej energie (ΔU) plynu, pretože táto veličina naznačuje, či plyn dostal alebo vzdal sa energie. Ak bola zmena vnútornej energie plynu pozitívna (ΔU> 0), bude plyn dostávať energiu; v opačnom prípade (ΔU <0) sa plyn vzdá časti svojej energie.
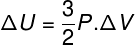
Zmena vnútornej energie z hľadiska zmeny objemu plynu.
Vnútorná energia pre kremeliny
Pre ideálne dvojatómové plyny je vnútorná energia daná mierne odlišnou rovnicou.
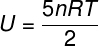
Vnútorná energia v termodynamických premenách a cykloch
Podľa 1. zákon termodynamiky, sa vnútorná energia ideálneho plynu môže v určitých prípadoch líšiť termodynamické transformácie, v závislosti od množstva tepla vymieňaného medzi okolím a systémom, ako aj od prác vykonaných systémom alebo na systéme.
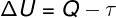
Q - teplo
τ - práca
Ďalej sa pozrime na to, akú formu má tento zákon pre niektoré konkrétne termodynamické transformácie.
Pozritiež:História tepelných strojov
→ Vnútorná energia: izotermická transformácia
O izotermická transformácianedochádza k žiadnej zmene teploty, a preto zostáva vnútorná energia konštantná.
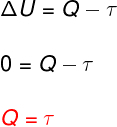
V takom prípade sa celé množstvo tepla, ktoré sa vymieňa so systémom, premení na prácu a naopak.
→ Vnútorná energia: izovolumetrická transformácia
O izovolumetrická transformácia, nie je možné vykonávať prácu, pretože systém je uzavretý v pevnom a nerozbaliteľnom obale. V takom prípade celé množstvo tepla, ktoré sa vymieňa so systémom, priamo mení jeho vnútornú energiu.
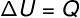
→ Vnútorná energia: izobarická transformácia
Pri tomto type transformácie je systém vystavený a konštantný tlak, Preto je možné prácu, ktorú vykonal on alebo ona na ňom, vypočítať analyticky.
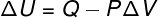
→ Vnútorná energia: adiabatická transformácia
V adiabatické transformácie, nedochádza k žiadnym výmenám tepla medzi systémom a jeho okolím, preto kolísanie vnútornej energie závisí výlučne od práce vykonávanej systémom alebo od systému.
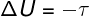
Vnútorná energia v cyklických procesoch
V každom cyklickom procese je termodynamický stav systému, predstavovaný jeho tlakovými, objemovými a teplotnými premennými (P, V, T), transformovaný, ale nakoniec sa vráti do pôvodného stavu (P, V, T), preto je variácia vnútornej energie v tomto type procesu vždy nulová (ΔU = 0).
Pozritiež:Cyklické transformácie
Pozrite sa na graf nižšie, ktorý zobrazuje tri odlišné termodynamické transformácie medzi stavmi A a B.
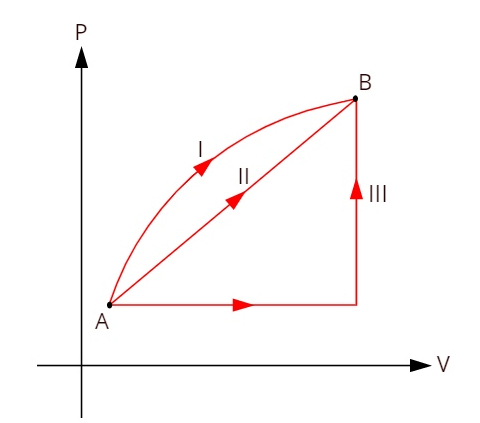
Pretože tri transformácie (I, II a III) opúšťajú stav A a prechádzajú do stavu B, musí byť variácia vnútornej energie pre všetky z nich rovnaká, preto:
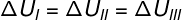
Cvičenie vnútornej energie
1) Dva moly ideálneho dvojatómového plynu s molárnou hmotnosťou rovnajúcou sa 24 g / mol sa nachádzajú pri teplote 500 K v uzavretej tuhej nádobe s objemom rovným 10-3 m³. Určiť:
a) Modul vnútornej energie tohto plynu v jouloch.
b) Tlak, ktorý plyn vyvíja na steny nádoby.
Rozhodnutie:
) Pretože je to ideálny a dvojatómový plyn, na výpočet jeho vnútornej energie použijeme nasledujúci vzorec:
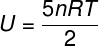
Ak vezmeme údaje, ktoré boli uvedené vo vyhlásení o cvičení, bude potrebné vyriešiť nasledujúci výpočet:
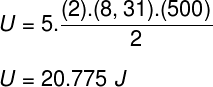
B) Tlak, ktorý plyn vyvíja, môžeme určiť, keď poznáme objem jeho nádoby: 10-3 m³. Použijeme na to nasledujúci vzorec:
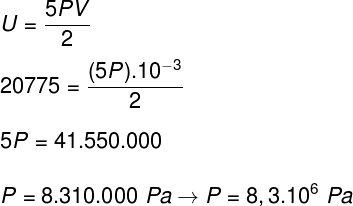
Mnou. Rafael Helerbrock