Hliník sa získava metalurgickými procesmi. Metalurgia je oblasť, ktorá skúma transformáciu rúd na kovy alebo kovové zliatiny. Touto metódou sa získa niekoľko kovov, napríklad meď, titán, železo a mangán.
V prípade hliníka je hlavnou použitou rudou bauxit (obrázok), ktorý obsahuje hydratovaný oxid hlinitý (Aℓ2O3. x H2O) a rôzne nečistoty.

V metalurgii hliníka prebiehajú nasledujúce štyri kroky:
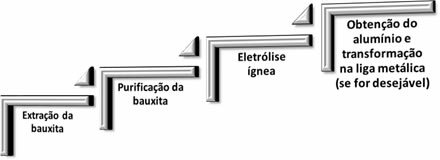
Keď oxid hlinitý (Aℓ2O3 s) je oddelený od bauxitu, jeho názov sa stáva oxid hlinitý.
Predtým sa robilo nasledovné: oxid hlinitý sa spracoval s kyselinou chlorovodíkovou za vzniku chloridu hlinitého; ktorá bola umiestnená tak, aby reagovala s kovovým draslíkom alebo sodíkom, spôsobila redukciu zlúčeniny a dala vzniknúť kovovému hliníku:
Aℓ2O3 s + 6 HCℓ(tu)→ 4 AℓCℓ3 (aq) + 3 H2O(ℓ)
ACℓ3 (aq) + 3 tiss→ 3 KCℓs + Aℓs
Táto metóda však bola veľmi drahá a neefektívna, preto sa hliník považoval za vzácny kov.
Ale v roku 1886 dvaja vedci osobitne vyvinuli vyššie spomenutú metódu, pri ktorej sa použila magmatická elektrolýza. Týmito vedcami boli Američan Charles M. Hall a Francúz Paul Héroult, preto sa táto metóda začala nazývať
Hall-Héroultov proces alebo jednoduchoHallov proces, keďže Charles M. Hall si to dal patentovať.Kľúčovým bodom, ktorý objavili, bolo, ako pripraviť tekutý oxid hlinitý. byť schopný vykonávať magmatickú elektrolýzu, pretože problémom bolo, že jeho teplota topenia bola vyššia 2 000 ° C. Použili tavidlo, kryolitovú rudu (Na3AℓF6), ktorý dokázal znížiť teplotu topenia oxidu hlinitého na asi 1 000 ° C.
Ako je znázornené na nasledujúcom diagrame, bola táto zmes oxidu hlinitého a kryolitu umiestnená do oceľovej elektrolytickej nádoby s uhlíkovou vrstvou. Touto roztavenou zmesou prechádza elektrický prúd. Steny nádoby, ktoré sú v kontakte so zmesou, pôsobia ako negatívny pól elektrolýzy (katódy), pri ktorom dochádza k redukcii katiónov hliníka. Anóda (kladný pól) sú valce vyrobené z grafitu alebo uhlíka, to znamená, že obidva sú vyrobené z uhlíka, kde dochádza k oxidácii kyslíkových aniónov:
Teraz neprestávajte... Po reklame je toho viac;)
Poloreakcia katódy: 4 Aℓ3+(ℓ) + 12 a- → 4 Aℓ(ℓ)
Anóda s polovičnou reakciou: 602-(ℓ) → 12 a- + 3 O.2 písm. G)
Vytvorený kyslík reaguje s uhlíkom v anóde a tiež generuje oxid uhličitý:
3 O.2 písm. G) + 3 ° Cs → 3 CO2 písm. G)
Takže celková reakcia a schéma tejto magmatickej elektrolýzy, pri ktorej vzniká hliník, je daná vzorcom:

Získaný hliník je v tekutej forme, pretože jeho teplota topenia je 660,37 ° C, teda nižšia ako teplota topenia zmesi oxidu hlinitého a kryolitu. Hliník je tiež hustejší ako zmes, a preto sa ukladá na dne nádoby, kde sa zhromažďuje.
Pri výrobe 1 tony hliníka sa používa:
- 4 až 5 ton bauxitu, odkiaľ asi 2 tony oxidu hlinitého;
- 50 kilogramov kryolitu (prírodných zdrojov kryolitu nie je veľa, preto sa zvyčajne získava ich syntézou z fluoritu (CaF2), najbohatšej minerálnej látky v prírode);
- 0,6 tony uhlia pre elektródy.
Ročne výroba hliníka presahuje 27,4 milióna ton.
Medzi hlavné zliatiny hliníka patria:

Autor: Jennifer Fogaça
Vyštudoval chémiu
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
FOGAÇA, Jennifer Rocha Vargas. „Získanie hliníka elektrolýzou“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/obtencao-aluminio-por-meio-eletrolise.htm. Prístup k 28. júnu 2021.
Chémia

Aplikácie elektrolýzy, galvanického pokovovania, niklovania, chrómovania, niklu, chrómu, katódy, sodíka, hliníka, chlóru, lúh sodný, plynný vodík, magmatické elektrolýzy, vodná elektrolýza, alkalické kovy, kovy alkalických zemín, plyn chlór.


