Prvky rodiny 17 alebo VII A periodickej tabuľky sa nazývajú halogény, reprezentované piatimi nižšie uvedenými prvkami: Fluór (F), chlór (Cl), bróm (Br), jód (I) a astatín (At). Často sú všeobecne predstavované písmenom X.

Najdôležitejšie sú z dôvodu ich každodenného použitia chlór, bróm a jód.
Tento názov „halogén“ znamená „tvoriaci soľ“.
Všetky z nich majú 7 elektrónov vo valenčnom plášti (elektronický obal najvzdialenejší od jadra a energetickejší). Spravidla: ns2 np5. Vo výsledku majú tendenciu prijímať elektrón a vytvárať negatívne jednomocné ióny (X-1), reagujúci hlavne s alkalickými kovmi (kovy skupiny 1), ktoré majú tendenciu darovať elektrón. Dávajú teda vznik zlúčeninám so vzorcami typu MX.

Získaním tohto elektrónu sú halogény stabilné, pretože ich valenčný obal je úplný (s ôsmimi elektrónmi) a ich charakteristiky sa úplne menia. Napríklad plynný chlór (Cl2) je zelenožltý, hustý, vysoko toxický a reaktívny plyn, ťažko rozpustný vo vode a explozívne reaguje s vodíkom. Keď však chlór
(Cl) prijíma elektrón zo sodíka (Na), stávajú sa z nich ióny a vytvárajú chlorid sodný (NaCl) alebo kuchynskú soľ, ktorú prijímame každý deň a ktorá je nevyhnutná na udržanie nášho života. Chlór sa stáva najmä chloridovým iónom (Cl-), ktorá je v našom tele nevyhnutná na tvorbu kyseliny chlorovodíkovej (HCl), hlavnej zložky našej žalúdočnej šťavy.V skutočnosti je chlór najpočetnejším z halogénov a používa sa pri výrobe organických zlúčenín, anorganické látky, vo výrobe papiera (zamerané na bielenie buničiny) a vo vode a stoky. Je tiež bežné používať vodný roztok chlórnanu sodného (NaClO), ktorý sa nazýva „kvapalný chlór“ a ktorý je v zložení bielidla.
Teraz neprestávajte... Po reklame je toho viac;)
Zaujímavým faktom je, že hoci niektorí ľudia tvrdia, že v bazénoch sa používa „tuhý chlór“, v skutočnosti to nie je iba chlór, ale aj chlórnan vápenatý (Ca (ClO)2).
Podobným prípadom je tiež použitie fluór - čo v skutočnosti nie je samotný fluór, ale fluoridy (iónové zlúčeniny, ktoré obsahujú prvok fluór) - v liekoch na pitnú vodu a vo výrobkoch na starostlivosť o ústnu dutinu.
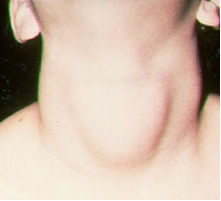
S ohľadom na jód, dôležitou aplikáciou je ich zákonom požadované pridanie (vo forme jodidov alebo jodičnanu sodného a draselného) do kuchynskej soli. Je to tak preto, lebo nedostatok jódu v tele môže spôsobiť ochorenie zvané struma, ľudovo papo.
O brómu je to červená kvapalina, pri izbovej teplote, hustá a nestabilná a keďže je prchavá, môže sa odparovať a vytvárať červenkastú paru. V prírode sa nenachádza izolovane a ani sa takýmto spôsobom nepoužíva v priemysle. Hlavné použitia jeho zlúčenín sú: ako katalyzátory organických reakcií zmiešaných s palivami, okrem iného pri fotografickom vývoji.
už je astatín je to rádioaktívny prvok. Jeho pôvod je zvyčajne výsledkom rádioaktívneho rozpadu izotopov uránu a tória. Tvorí najmenej 20 izotopov, pričom At-210 je najstabilnejší s polčasom 8,3 hodiny. Je to veľmi vzácny prvok.
Autor: Jennifer Fogaça
Vyštudoval chémiu