O Fázový diagram je graf používaný na označenie teplotných podmienok a tlak potrebné na získanie a látka v istom fyzický stav (pevné, tekutý alebo plynné).
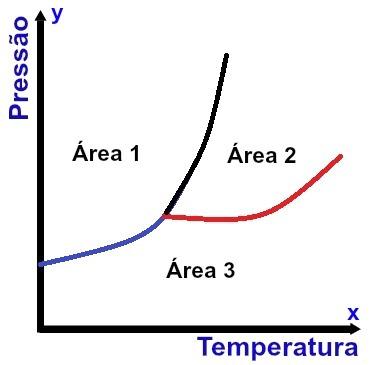
Reprezentácia fázového diagramu
Os x (vodorovná) obsahuje hodnoty teploty a os y (zvislá) obsahuje hodnoty tlaku. Okrem toho sú k jednému bodu (nazývanému trojitý bod) pripojené tri krivky, ktoré rozdeľujú graf na tri presne definované oblasti, ako je zrejmé z vyššie uvedeného diagramu.
Okrem označenia podmienok, aby bola látka v špecifickom fyzickom stave, Fázový diagram označuje podmienky pre akúkoľvek zmenu fyzikálneho stavu.
Zmeny fyzického stavu sú:
Fúzia: prechod z tuhého do kvapalného skupenstva;
Tuhnutie: prechod z kvapalného do tuhého skupenstva;
Odparovanie: prechod z kvapalného do plynného skupenstva;
Kondenzácia: prechod z plynného do kvapalného skupenstva;
Sublimácia: prechod z tuhého do plynného skupenstva;
Resublimácia: prechod z plynu na tuhý stav.
a) Regióny
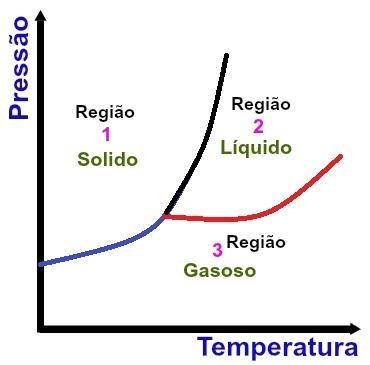
Základné oblasti fázového diagramu
Región 1
Oblasť 1 označuje teplotné a tlakové podmienky, za ktorých nájdeme látku v tuhom stave.
Región 2
Oblasť 2 označuje teplotné a tlakové podmienky, za ktorých nájdeme látku v tekutom stave.
Región 3
Oblasť 3 označuje teplotné a tlakové podmienky, v ktorých nájdeme látku v plynnom skupenstve.
b) Krivky

Krivky prítomné vo fázovom diagrame
Krivka A (fialová krivka)
Je to krivka, ktorá rozdeľuje pevnú a plynnú oblasť fázového diagramu a bežne sa nazýva krivka resublimácie. Každý bod umiestnený na krivke 1 naznačuje, že máme určitú látku koexistujúcu v tuhom a plynnom skupenstve.
Teraz neprestávajte... Po reklame je toho viac;)
Okrem indikácie koexistencie krivka 2 tiež označuje teplotné a tlakové podmienky pre transformáciu látky z kvapalného do plynného stavu.
Krivka B (čierna krivka)
Je to krivka, ktorá rozdeľuje tuhú a kvapalnú oblasť fázového diagramu a bežne sa nazýva krivka tuhnutia. Každý bod umiestnený na krivke 2 naznačuje, že máme určitú látku koexistujúcu v tuhom a plynnom skupenstve.
Okrem indikácie koexistencie krivka 2 tiež označuje teplotné a tlakové podmienky pre transformáciu látky, ktorá je v kvapalnom stave, do tuhého stavu.
Krivka C (červená krivka)
Je to krivka, ktorá rozdeľuje tuhú a plynnú oblasť fázového diagramu a bežne sa nazýva kondenzačná krivka. Každý bod umiestnený na krivke 3 naznačuje, že máme určitú látku koexistujúcu v tuhom a plynnom skupenstve.
Okrem indikácie koexistencie krivka 3 tiež naznačuje teplotné a tlakové podmienky pre transformáciu látky z tuhého na plynný stav a naopak.
c) Trojitý bod
Bod, kde sa stretávajú tri krivky vo fázovom diagrame, sa nazýva trojitý bod. V tomto okamihu máme hodnotu teploty a hodnotu tlaku, pri ktorých nájdeme látku súčasne v tuhom, kvapalnom aj plynnom skupenstve.

d) Zmeny fyzikálneho stavu vo fázovom diagrame
Vo nižšie uvedenom fázovom diagrame máme 6 šípok, ktoré označujú smer zmien fyzikálnych stavov látky.

Šípka 1: označuje zlúčenie
Šípka 2: označuje tuhnutie
Šípka 3: označuje odparovanie
Šípka 4: označuje kondenzáciu
Šípka 5: označuje sublimáciu
Šípka 6: označuje resublimáciu
Podľa mňa. Diogo Lopes Dias
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
DNI, Diogo Lopes. „Čo je to fázový diagram?“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-diagrama-fases.htm. Prístup k 28. júnu 2021.
Chémia

Transformácie kvapalín, odparovanie, medzimolekulové sily, premrznutie kvapaliny, kvapalná kryštalizácia, kalenie, viskozita kvapaliny, tlak kvapalných pár, atmosférický tlak, zmrazenie kvapaliny, teplota
Chémia

Kvapaliny, Povrchové napätie, fúzia tuhej látky, kondenzácia plynu, viskozita, tekutina, konštantný objem, molekuly plynu, medzimolekulové sily, kompresia, odparovanie kvapaliny.
