chemický prvok fosfor (P) patrí do tretieho obdobia periodickej tabuľky a do rodiny dusíkatých látok (VA). Z tohto dôvodu tvoria jeho atómy zvyčajne tri chemické väzby dosiahnuť teória oktetu (stabilita). Existujú však situácie, v ktorých atóm fosforu vytvára viac ako tri väzby, čo je možné iba prostredníctvom hybridizačný jav.
Aby sme pochopili hybridizácia fosforu, najskôr musíme pochopiť, prečo atóm tohto prvku vytvára tri väzby. Aby sme to dosiahli, musíme iba sledovať vašu elektronickú distribúciu:

Elektronická distribúcia fosforu
Môžeme pozorovať, že vo valenčnej vrstve má atóm fosforu celú podúrovňu 3 s (s dva elektróny) a neúplná podúroveň 3p (každý z troch p podúrovní orbitalov má a elektrón). Ďalej máme distribúciu elektrónov na orbitáloch nižších úrovní Valenčná vrstva fosforu:
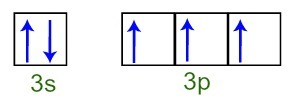
Reprezentácia elektrónov valenčnej škrupiny atómu fosforu
Pretože každý z orbitalov pod úrovňou 3p je neúplný, atóm fosforu je schopný vytvoriť tri chemické väzby, čím sa dosiahne stabilita.
Teraz, keď sa pozrieme na látku PCl
5napríklad sme si istí, že v tejto molekule prešiel fosfor hybridizáciou, pretože vytvoril päť spojení. Pretože chlór, ktorý patrí do rodiny VIIA, potrebuje väzbu, aby bol stabilný, a molekula má z toho päť atómov prvok, každý z nich musí vytvoriť väzbu, vďaka ktorej musí atóm fosforu tiež vytvoriť päť Pripojenia. Tento výskyt je možný iba prostredníctvom hybridizácia (spojenie neúplných atómových orbitálov) fosforu.Teraz neprestávajte... Po reklame je toho viac;)
Pri príjme energie z vonkajšieho prostredia sa elektróny atómu fosforu vzrušujú. Čoskoro potom sa jeden z dvoch elektrónov patriacich do podúrovne 3s presunie na prázdny orbitál prítomný v podúrovni d, ktorý do tej doby nemá žiadne elektróny. Pozrite si nasledujúci diagram:
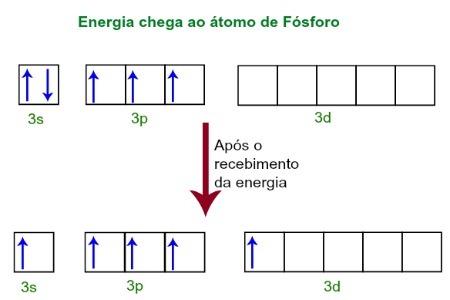
Po prijatí energie sú elektróny fosforu excitované a jeden zaberá obežnú dráhu podúrovne d.
V tejto chvíli máme vo valenčnej vrstve fosforu s orbitál, tri p orbitaly a neúplný d orbitál.Nakoniec sa týchto päť orbitálov hybridizuje, to znamená, že sa zlúčia, čo má za následok päť neúplných atómových orbitálov, ktoré sú dnes schopné vytvárať päť chemických väzieb.

Hybridizácia neúplných atómových orbitálov fosforu
Pretože boli spojené orbitál, tri orbitaly p a d orbitál, hybridizácia fosforom je typu sp3d.
Podľa mňa. Diogo Lopes Dias
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
DNI, Diogo Lopes. „Hybridizácia fosforu“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm. Prístup k 28. júnu 2021.


