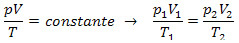Podľa prvého termodynamického zákona je v akomkoľvek termodynamickom procese množstvo tepla Q prijatý systémom sa rovná práci, ktorú vykonal, plus variácia jeho vnútornej energie.
Keď je tlak konštantný, teplo vymieňané systémom s externým médiom sa používa na prácu a na zmenu vnútornej energie. V mnohých praktických situáciách sú systémy vystavené atmosférickému tlaku, ako je to v prípade chemickej reakcie. Vyššie uvedený obrázok zobrazuje FV diagram tohto typu procesu.
V tomto prípade, v rovnici prvého zákona,
Q = τ + ∆U
žiadny z výrazov nie je nulový. Práca je písaná ako funkcia objemovej zmeny volumeV, ako napríklad:
τ = P.∆V
Pre konkrétny prípad ideálneho jednoatómového plynu možno energiu napísať nasledovne:
Teraz neprestávajte... Po reklame je toho viac;)

Preto môžeme prvý zákon termodynamiky napísať ako funkciu ΔV:


Teplo vymenené s médiom je (5/2) P.ΔV a 40% z celkového množstva - čo zodpovedá P.ΔV - sa používa na prácu; a (3/2) P.ΔV, čo zodpovedá 60% celkového množstva, sa používajú na zmenu vnútornej energie. Tento výsledok platí pre ideálny jednoatómový plyn.
Teplo súvisí s teplotnými zmenami (podľa zákona o ideálnom plyne):

Dodané teplo sa dá teda vypočítať podľa zmeny teploty alebo podľa zmeny objemu.
Autor: Domitiano Marques
Vyštudoval fyziku
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
SILVA, Domitiano Correa Marques da. „Prvý zákon pre izobarické procesy“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isobaricos.htm. Prístup k 27. júnu 2021.