THE soľný most navrhol anglický chemik Frederic Daniell v roku 1836, keď tento vedec zriadil batéria pomenované po ňom (Danillova hromada). tento most je trubica v tvare U, ktorá má dva pórovité konce. (pozostávajúci z bavlny alebo agaru-agaru) a obsahuje vodný roztok tvorený vodou a soľou. Nepriamo spája roztoky dvoch polčlánkov článku (anódy a katódy).
Pozorovanie: Anóda je záporný pól batérie a je to miesto, kde dochádza k oxidácii, a katóda je kladný pól a dochádza k redukcii.
Aby sme pochopili dôležitosť soľného mosta, je spočiatku potrebné pochopiť fungovanie hromady. Pozrite si nasledujúci diagram:
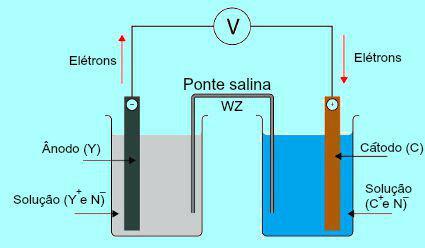
Všeobecná schéma komíny Daniell
Spočiatku kov (Y) dosky prítomnej v anóde podlieha oxidácii. Pri oxidácii sa kov premení na katión, ktorý spadne do roztoku, v ktorom je platňa. Z tohto dôvodu začne anódový roztok predstavovať vyššiu koncentráciu katiónov (Y+). V tomto prípade je pozorovaný pokles anódovej kovovej platne.
Y → a- + Y.+
Potom elektróny stratené počas oxidácie kovu anódovej platne prechádzajú vonkajším elektrickým drôtom a prechádzajú na kovovú platňu prítomnú v katóde. Doska prítomná na katóde sa teda nabije elektrónmi.
-
Tieto katióny (C+) v roztoku sa posúvajte smerom ku katódovej doske, pretože je nabitý elektrónmi. Keď katióny získajú elektróny prítomné v doske, stanú sa neutrálnymi (stabilnými a pevnými) a priľnú k nim. Z tohto dôvodu predstavuje katódový roztok vyššiu koncentráciu aniónov ako katiónov. V tomto prípade je možné pozorovať zväčšenie veľkosti katódovej kovovej platne.
Teraz neprestávajte... Po reklame je toho viac;)
Ç+ + a- → C.
Z pochopenia toho, ako Daniellina hromadaje možné pozorovať, že roztok prítomný v anóde prijíma väčšie množstvo katiónov Y.+ v dôsledku oxidácie kovu dosky X. Roztok prítomný v katóde naopak stráca svoje katióny (C+), pretože trpia znížením tvorby zubného povlaku.
Presne v tejto otázke je vyzdvihnutá práca soľného mosta. Hlavnou funkciou tohto mostíka je podpora rovnováhy nábojov prítomných v anódovom aj katódovom roztoku. V soľnom mostíku máme vždy soľ (zvyčajne chlorid draselný alebo dusičnan amónny.) Disociovaný vo vode. Pozrite si znázornenie rovnice v soľnom mostíku:
WZ + H2O → W+ + Z-
V soľnom moste sú dva ióny (W+ a Z-), ktoré sú posunuté na katódu a anódu podľa:
) Anóda prijíma anióny (Z-) prítomné v soľnom mostíku v dôsledku oxidácie prvku (Y), čo spôsobuje zvýšenie množstva katiónov (Y+) v roztoku.
B) Katóda prijíma katióny (W+) soľného mostíka, pretože počas prevádzky na batériu katión (C.+) prítomný v roztoku je na doske znížený. Katódový roztok má teda väčšie množstvo aniónov (N-), a preto prijíma katión prítomný v soľnom mostíku.
Podľa mňa. Diogo Lopes Dias
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
DNI, Diogo Lopes. „Plachetný most“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. Prístup k 28. júnu 2021.