Kyseliny sú látky, ktoré ionizovať vo vodnom prostredí a sú dobré vodičov moc. Kyslosť látky sa dá merať technikami na meranie vodíkového iónového potenciálu (pH) riešenia. Niektoré analytické metódy pH používajú indikátory ako lakmusový papier alebo fenolftaleín, ktoré farebne odrážajú hodnotu pH roztoku.
Kyseliny možno charakterizovať:
prítomnosťou alebo bez prítomnosti kyslíka v jeho molekule;
silou;
ionizovateľnými vodíkmi;
svojou volatilitou.
Prečítajte si tiež:Porovnanie medzi kyselinami a zásadami - rozdiely a vlastnosti
Charakteristika kyselín
Ionizujú vo vodnom prostredí a uvoľňujú katión H.+.
Sú to vodiče elektriny v dôsledku uvoľnenia ióny vo vodnom prostredí.
V kontakte so základným prostredím trpia neutralizačná reakcia, pričom ako produkty tejto reakcie vzniká soľ a voda.
Menia farbu roztoku za prítomnosti indikátorovej látky, ako je lakmusový papier alebo fenolftaleín.
Kyslá príchuť citrónu, pomaranča, okrem iných citrusových plodov, je spôsobená kyselinou prítomnou v týchto potravinách.
Teraz neprestávajte... Po reklame je toho viac;)
Vodíkový potenciál (pH)
Potenciál vodíkových iónov (pH) je výpočet, ktorý vyjadruje iónová koncentrácia vodík v istom Riešenie. Pri stanovení pH a analýze média sa berie do úvahy nasledujúce skutočnosti:
Ostwaldov zákon riedenia (čím viac zriedený, tým viac iónov sa vytvorí v roztoku);
autoionizácia vody (Kw), čo je prirodzený rozklad molekuly H2O v H iónoch+ a oh-;
destilovaná voda pri 25 ° C má autoionizáciu Kw = 10-14 a rovnaká koncentrácia iónov H+ a oh-, to znamená, že je to neutrálne médium.
Na výpočet pH zahŕňajúci koncentráciu H.+, použitie: pH = -log [H+].
Viem, že:
pH> 7 → zásaditý roztok
pH <7 → kyslý roztok
pH = 7 alebo pH = pOH → neutrálny roztok
Pozri tiež: Aké sú kyslé vzorce?

Klasifikácia kyselín
THE klasifikácia kyselín možno zohľadniť štyri rôzne kritériá.
Stupeň ionizácie (α) alebo sila kyseliny
α = počet ionizovaných molekúl
počet rozpustených molekúl
Silné kyseliny: α ≥ 50%.
Príklad: ákyselina sírový (H2IBA4) → α = 61%.Polosilné alebo stredne silné kyseliny: 5% < α < 50%.
Príklad: kyselina fosforečná (H3PRACH4) → α = 27%.Slabé kyseliny: α ≤ 5%.
Príklad: kyselina boritá (H3BO3) → α = 0,075%.
→ Počet ionizovateľného vodíka
monokyselina: uvoľňuje katión H.+.
Príklad: ákyselina chlorovodíková (HCL);
dikyselina: uvoľňuje dva H katióny+.
Príklad: sírovodík (H2S).Triacid: uvoľňuje tri H katióny+.
Príklad: kyselina boritá (H3BO3).tetracid: uvoľňuje štyri H katióny+.
Príklad: kyselina pyrofosforečná (H4P2O7).
Pozor! V prípade hydrokrídov sú všetky vodíky v molekule ionizovateľné; ale v prípade kyslíkových kyselín sú ionizovateľné iba vodíky, ktoré sú naviazané na atóm kyslíka. Príkladom je kyselina fosforná (H3PRACH2), čo je monokyselina, pretože napriek tomu, že má vo svojom zložení tri vodíky, uvoľňuje iba vodík, ktorý je viazaný na kyslík.
→ Prítomnosť kyslíka
oxykyseliny: majú vo svojej štruktúre kyslík.
Príklad: kyselina chlórna (HO Cl).
Hidracidy: nemajú vo svojej štruktúre kyslík.
Príklad: kyselina fluorovodíková (HF).
→ Volatilita
Opravené: bod varu(NOHY) > 100 ° C, pomaly prechádza do plynného stavu.
Príklad: kyselina sírová (H2IBA4) → PE = 340 ° C.prchavé látky: bod varu <100 ° C, rýchlo a ľahko sa mení na plynný stav.
Príklad: sírovodík (H2S) → PE = -59,6 ° C.
Kyselinová nomenklatúra
→ Hidracidy
Kyselina + aniónový názov + hydr
Pre všetky kyseliny sa pred názvoslovím, ktoré charakterizuje molekulu, používa výraz „kyselina“. V hydracidoch sa prípona „eto“ názvu prvku nahrádza „hydric“.
Príklady:
HCl → kyselina chlórhydric
HBr → kyselina brómhydric
HF → kyselina fluórhydric
→ oxykyseliny
Nomenklatúra oxykyselín sa líši podľa oxidačné číslo (NOX) centrálneho prvku. Pozri tabuľku nižšie:
NOX centrálneho prvku |
Kyselinová nomenklatúra |
||
prefix- |
-infix- |
- prípona |
|
+1 a +2 |
Hroch |
-anion meno- |
-oso |
+3 a +4 |
-- |
Aniónové meno- |
-oso |
+5 a +6 |
-- |
Aniónové meno- |
-icic |
+7 |
Za |
-anion meno- |
-icic |
Príklady:
HClO → S vedomím, že vodík (H) má normálne NOX +1 a kyslík (O) má NOX -2, aby sme mali molekulu náboja 0, musí chlór (Cl) mať NOX +1, takže nomenklatúra tejto kyseliny je kyselina chlórna.
HNO2 → kyselina dusitá
HClO4 →ákyselinaperchlórny
→ Výnimky z pravidla
H2CO3 → kyselina uhličitá, a nie uhlíkaté, ako by to bolo podľa pravidla NOX.
H3BO3 → ákyselina boric, a nie nudné.
Kyseliny v každodennom živote
Hnojivá a lieky: Kyselina fosforečná (H3PRACH4) sa široko používa pri výrobe hnojív a tiež ako liečivo. Je to jedna z niekoľkých kyselín, ktoré sa používajú vo farmaceutickej oblasti.
Citrusové ovocie: majú kyselinu askorbovú (C.6H8O6), taktiež známy ako Vitamín C.
Ocot: má vo svojom zložení Octová kyselina (CH3COOH).
- Perlivá voda a nealkoholické nápoje: zložený z kyseliny uhličitej (H2CO3), ktorá dodáva výrobku osviežujúci pocit.
Tiež prístup:Úloha kyselín v nealkoholických nápojoch

vyriešené cviky
Otázka 1 - (Enem) Šťava extrahovaná z červenej kapusty sa môže použiť ako indikátor kyslého charakteru (pH medzi 0 a 7) alebo zásaditého (pH medzi 7 a 14) rôznych roztokov. Primiešaním trochy kapustovej šťavy a roztoku začne zmes podľa kyslej alebo zásaditej farby meniť podľa nasledujúcej stupnice rôzne farby.
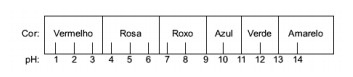
Niektoré riešenia boli testované pomocou tohto indikátora a priniesli nasledujúce výsledky:
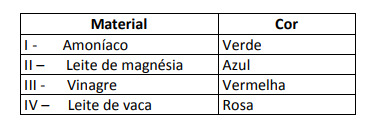
Podľa týchto výsledkov majú riešenia I, II, III a IV nasledujúci charakter:
A) kyslé / zásadité / zásadité / kyslé.
B) kyslá / zásaditá / kyslá / zásaditá.
C) zásaditá / kyslá / zásaditá / kyslá.
D) kyselina / kyselina / zásaditá / zásaditá.
E) Základné / Základné / Kyselina / Kyselina.
Rozhodnutie
Alternatíva E. Na určenie, či má látka kyslý, zásaditý alebo dokonca neutrálny charakter, sa vykoná analýza farieb získaných pri teste vo vzťahu k údajom danej stupnice. S vedomím, že roztoky s pH = 7 sú neutrálne, pH> 7 je zásadité a s pH <7 sú kyslé, dospejeme k záver, že čpavok a magnéziové mlieko sú základné látky a ocot a kravské mlieko áno kyselín.
Otázka 2 - (PUC-Camp) Pokiaľ ide o látky nazývané kyseliny, študent si všimol tieto vlastnosti:
I - mám korozívnu silu;
II - sú schopné neutralizovať bázy;
III - sú zložené z dvoch chemických prvkov;
IV - tvoria vodné roztoky, ktoré vedú elektrický prúd.
Urobil chyby IBA v
A) I a II
B) I a III
C) I a IV
D) II a III
E) III a IV
Rozhodnutie
Alternatíva B. Nie všetky kyseliny sú korozívne, iba tie najsilnejšie a kyseliny môžu pozostávať z dvoch alebo viacerých atómov.
Laysa Bernardes
Učiteľ chémie
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
ARAúJO, Laysa Bernardes Marques de. „Kyseliny“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/acidos.htm. Sprístupnené 27. júna 2021.