Nitrozlúčenina je organická zlúčenina pochádzajúca z chemickej reakcie medzi kyselinou dusičnou (HNO3) je to alkán (nasýtený uhľovodík s otvoreným reťazcom) alebo aromatický. Keď kyselina dusičná reaguje s alkánom alebo aromatický, nastáva substitučná reakcia, pri ktorej kyselina stratí hydroxylovú skupinu (OH) a organická zlúčenina stratí vodík:
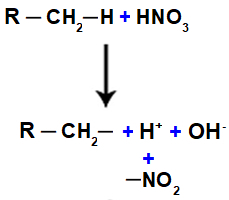
Ďalej máme formáciu molekuly vody, ktorá je výsledkom spojenia medzi OH a H, zatiaľ čo ŽIADNA skupina2 (ktorý zostane z kyseliny) sa viaže na alkán alebo aromatický a vytvára nitrozlúčenina.
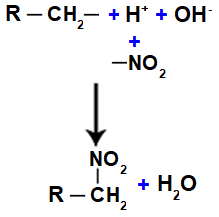
Zastúpenie vody a tvorby nitrozlúčenín
Teda hlavným štrukturálnym znakom a nitrozlúčenina je prítomnosť jedného alebo viacerých nitroskupiny (NA2) spojené s alkánom alebo aromatickou látkou.
vlastnosti
S ohľadom na vlastnosti fyzické, môžeme zdôrazniť:
Všeobecne ide o viskózne kvapaliny pri izbovej teplote (s výnimkou nitrozlúčeniny s nízkou molárnou hmotnosťou, čo sú tekuté kvapaliny);
Majú vysoké teploty topenia a varu;
Sú hustejšie ako voda;
Všeobecne sú nerozpustné vo vode, s výnimkou nitrometánu a nitroetánu;
Ak sú tvorené alifatickým reťazcom, majú príjemnú arómu a nie sú jedovaté. Teraz, ak sú tvorené aromatickým reťazcom, sú jedovaté a majú nepríjemnú arómu;
O typ medzimolekulovej sily ktorý spája svoje molekuly, je permanentný dipól, pretože majú polárne charakteristiky.
Pokiaľ ide o chemické vlastnosti, musíme vedieť, že: nitrozlúčeniny sú veľmi reaktívne, to znamená, že sa používajú pri rôznych organických reakciách, ako sú napríklad substitučné reakcie.
Oficiálne pravidlo nomenklatúry navrhované IUPAC (Medzinárodná únia pre čistú a aplikovanú chémiu) pre nitrozlúčeniny é:
Teraz neprestávajte... Po reklame je toho viac;)
Nitro + predpona + infix + o
Poznámka: Predpona súvisí s počtom uhlíkov prítomných v reťazci nitrozlúčeniny. Infix súvisí s typom väzieb prítomných medzi uhlíkmi.
Príklady:
Nomenklatúra normálnej reťazcovej nitrozlúčeniny

Spočiatku je zaujímavé očíslovať reťazec nitrozlúčenina (vždy od uhlíka najbližšieho k uhlíku, ktorý má nitroskupinu):
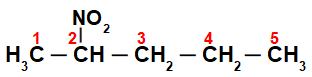
Číslovaním reťazca znaku nitrozlúčenina, máme v ňom päť atómov uhlíka (predpona pent), iba jednoduché väzby medzi uhlíkmi (infix an) a nitroskupinou na uhlíku 2. Názov tejto štruktúry je 2-nitropentán.
Nomenklatúra normálnej reťazcovej nitrozlúčeniny
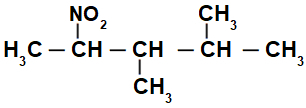
Štruktúrny vzorec rozvetvenej nitrozlúčeniny
Spočiatku je zaujímavé očíslovať reťazec nitrozlúčenina (vždy od uhlíka najbližšieho k uhlíku, ktorý má nitroskupinu) až po koniec, ktorý má najvyšší počet uhlíkov pre hlavný reťazec:
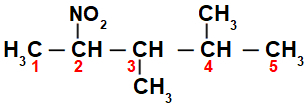
Číslovaním reťazca znaku nitrozlúčenina, máme, že v ňom je 5 atómov uhlíka (predpona pent), iba jednoduché väzby medzi uhlíkmi (infix an), dva metylové radikály (na uhlíkoch číslo 3 a 4) a nitroskupina na uhlíku 2. Názov tejto štruktúry je 3,4-dimetyl-2-nitropentán.
Používa
Vy nitrozlúčeniny, všeobecne sa môžu použiť na výrobu pesticídov, farbív, anilínov, baktericídov, fungicídov, prísad, rozpúšťadiel; pôsobia tiež ako výbušniny a pri rafinácii ropy.
Podľa mňa. Diogo Lopes Dias
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
DNI, Diogo Lopes. „Čo je to nitrozlúčenina?“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-nitrocomposto.htm. Prístup k 28. júnu 2021.