Predstavy o konštitúcii hmoty (atómu) sa objavili v starovekom Grécku okolo roku 450 pred n. a., hlavne z krajín Demokritos a Leucipo. Atóm však v skutočnosti dostal vedecký charakter až po tzv Daltonova atómová teória.
THE Daltonova atómová teória bolo to zásadné pre rozvoj atómového poznania, pretože slúžilo ako základňa pre ďalších vedcov, aby poznali atóm a jeho vlastnosti.
Kto bol John Dalton?
Výcvikový chemik John Dalton sa narodil v anglickej Cumbrii v roku 1766 a zomrel v Manchestri 1844. Od malička bol jeho život predurčený na vedecký výskum a výučbu, a to tak, že učil alebo prispieval k rozvoju rôznych oblastí poznania.
Jeho najväčším dedičstvom ako vedca však bol vývoj prvej atómovej teórie. Bolo to vďaka niekoľkým experimentom spojeným so zmesou plynov a znalosťami prác navrhovaných Lavoisierom, v roku 1808 sa objavila Daltonova atómová teória.
Postuláty Daltonovej atómovej teórie
Daltonova atómová teória bola založená na experimentoch, ale žiadny z týchto experimentov nemohol jasne odhaliť atóm. Preto Dalton nazval atóm najmenšou časťou hmoty.
Daltonova teória predstavuje oveľa viac postulátov ako dôkazov. Niektoré z nich:
Atómy sú mohutné a sférického tvaru (podobné ako biliardová guľa);
Atómy sú nedeliteľné;
Atómy sú nezničiteľné;
Jeden chemický prvok je to súbor atómov s rovnakými vlastnosťami (veľkosť a hmotnosť);
Atómy rôznych chemických prvkov majú navzájom odlišné vlastnosti;
Na ich odlíšenie možno použiť relatívnu hmotnosť dvoch atómov;
Zložená chemikália je tvorená rovnakou kombináciou rôznych typov atómov;
Rôzne chemické látky vznikajú kombináciou rôznych atómov.
Znázornenie daltonského atómového modelu
Dalton nazval svoj atómový model biliardovou guľou, a preto začal reprezentovať atómy prvkov známych v jeho dobe pomocou sférických symbolov.
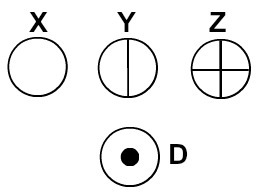
Atómy predstavované podľa Daltonovej atómovej teórie
Každá atómová reprezentácia, ktorá má konkrétny detail, označuje iný chemický prvok. Didakticky knihy a cvičenia na základnej a strednej úrovni predstavujú atómy iba v guľkách rôznych farieb.
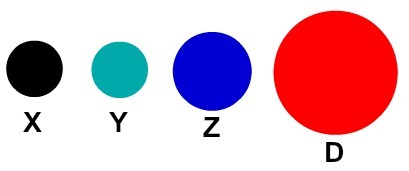
Didaktické znázornenie atómov
Príspevky Daltonovej atómovej teórie
porozumenie Lavoisierov zákon o zachovaní omše
Francúzsky chemik Lavoisier to tvrdil v roku 1785 „Pri chemickej reakcii sa hmotnosť zachováva, pretože nedochádza ani k vytváraniu, ani k ničeniu atómov ”. Daltonova atómová teória túto skutočnosť dokázala, pretože jeden z jeho postulátov uvádza, že atóm je nezničiteľný.
Preto, ak uskutočňujeme spaľovanie uhlia (C) v prítomnosti plynného kyslíka (O2), budeme mať chemickú reakciu medzi jedným atómom uhlíka a dvoma atómami kyslíka. Táto reakcia vytvorí oxid uhličitý (CO2), ktorý má úplne rovnaké atómy, z ktorých boli látky pripravené pred reakciou.
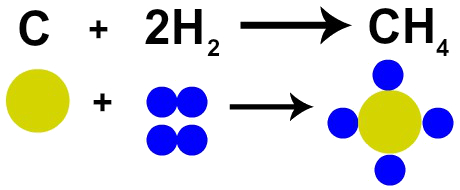
Zastúpenie Lavoisierovho zákona Daltonovým atómovým modelom
porozumenie jednoduché látky
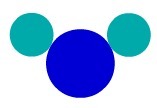
Pomocou Daltonov atómový model, môžeme rozumieť jednoduchú látku, to znamená látku, ktorá má atómy rovnakej charakteristiky tvoriace molekulu. Preto máme atómy patriace k rovnakému chemickému prvku.
V látke F2napríklad máme dva atómy fluóru, takže pri reprezentácii podľa Daltonovej atómovej teórie musíme použiť dva typy rovnakých atómov.

Jednoduché zastúpenie látok podľa Daltonov atómový model
porozumenie zložené látky
V zloženej látke máme atómy s rôznymi vlastnosťami, ktoré tvoria molekulu. Preto máme rôzne chemické prvky tvoriace látku.
Látka H2Napríklad O má tri atómy: dva vodík a jeden kyslík. Pozrite sa na jeho znázornenie podľa atómového modelu Daltona:
Zastúpenie zloženej látky podľa kožeDaltonov atómový model
Pochopenie zmesí
Pochopenie zmesi (spojenia dvoch alebo viacerých rôznych látok) prostredníctvom Daltonovej atómovej teórie je jednoduché: stačí vložiť dve rôzne molekuly do tej istej nádoby.

Zastúpenie druhej zmesi Daltonov atómový model
Ďalšie vedecké príspevky Johna Daltona
predstavil koncept atómová hmotnosť;
Formuloval zákon parciálnych tlakov plynov (Daltonov zákon);
Objavil zrakové postihnutie tzv Farbosleposť;
Študoval správanie výparov a plynov pri rôznych teplotách;
Zistil, že všetky plyny sa rozširujú (snažia sa obsadiť určité miesto) vo vesmíre rovnako.
Podľa mňa. Diogo Lopes Dias
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/teoria-atomica-dalton.htm


