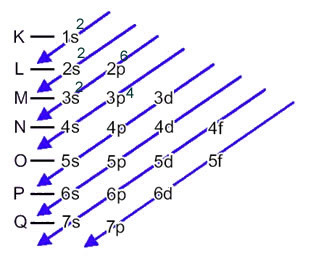
Elektronická distribúcia elektrónov atómu v neutrálnom alebo základnom stave sa bežne vykonáva s Paulingov diagram, zobrazené nižšie:
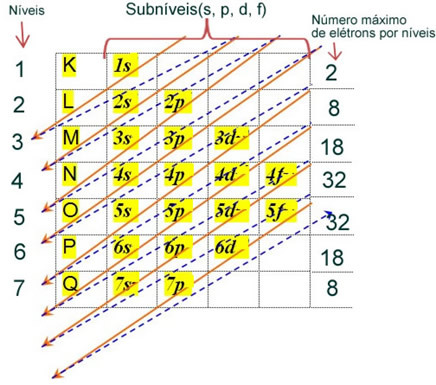
Podrobné pravidlá tejto distribúcie nájdete v nasledujúcich dvoch textoch na našej webovej stránke: “Elektronická distribúcia elektrónov„a“Pravidlá elektronickej distribúcie”.
Elektronická distribúcia iónov funguje spočiatku rovnakým spôsobom ako pre atómy v neutrálnom stave; iba s jedným rozdielom. Pretože ión je atóm, ktorý získal alebo stratil elektróny, musíme to brať do úvahy a robiť nasledovné:

Dôležitým postrehom je: zmena sa robí na najvzdialenejšej podúrovni a nie na najenergickejšej.
ak je ión a katión, musíme odstráňte elektróny že prehral. Pozrime sa na príklad:
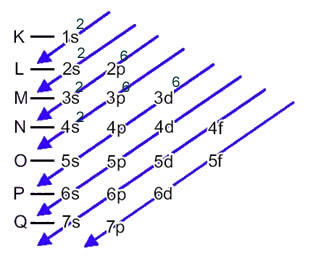
Atóm železa (atómové číslo = 26) má v podúrovniach v energetickom poradí nasledujúcu elektronickú distribúciu: 1 s2 2 s2 2 s6 3 s2 3s6 4 s2 3d6. Pokiaľ ide o elektronické vrstvy, máme: K =2; L = 8; M = 14; N = 2.
Táto distribúcia je uvedená v Paulingovom diagrame nižšie:
Keď atóm železa stratí 2 elektróny, premení sa na katión Fe.
2+. Takže pri vašej elektronickej distribúcii musíme odstráňte 2 elektróny z poslednej škrupiny(N) a nie najenergetickejšia úroveň, ako je uvedené nižšie: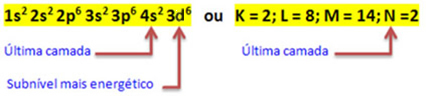
Teda elektronická distribúcia Fe katiónu2+ je daný:
1 s2 2 s2 2 s6 3 s2 3s6 3d6 alebo K = 2; L = 8; M = 14
Teraz, ak musíme vykonať elektronickú distribúciu a anión, musíme pridajte elektróny, ktoré prijal.Ako sa to deje, uvidíte v nasledujúcom príklade:
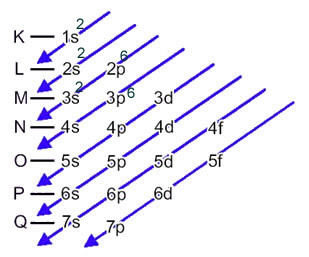
Sírový anión (16s2-) sa tvorí z atómu síry (16S) ziskom 2 elektrónov, ako to naznačuje náboj 2-. Jeho základná elektronická distribúcia je daná:
1 s2 2 s2 2 s6 3 s2 3s4 alebo K = 2; L = 8; M = 6
V tomto prípade je posledná podúroveň rovnaká ako podúroveň energie, 3p. Pridáme k tomu teda dva elektróny aniónu síry:
1 s2 2 s2 2 s6 3 s2 3s6 alebo K = 2; L = 8; M = 8
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/distribuicao-eletronica-ions.htm
