Články alebo elektrochemické články a batérie sú zariadenia, v ktorých sa chemická energia spontánne transformuje na elektrickú energiu.Bunka je tvorená iba dvoma elektródami a elektrolytom, zatiaľ čo batéria je súprava batérií v sérii alebo paralelne.
O primárne batérie nie sú nabíjateľné, pretože keď oxidačno-redukčná reakcia, ktorá v nich prebieha, prestane, musí sa zlikvidovať.
Pre každé zariadenie je uvedený typ batérie a z aktuálne používaných primárnych batérií sú hlavné tieto: Suché články Leclanché (bežné batérie alebo kyselinové články), alkalické batérie a batérie lítium / oxid manganičitý.
Zistite, čo ich odlišuje a pre aké zariadenia sú vhodné:
- Suché bunky Leclanché:
Tieto hromady sú v zásade tvorené zinkovým plášťom, ktorý je oddelený pórovitým papierom a centrálnou grafitovou tyčinkou obklopenou oxidom manganičitým (MnO).2), práškové uhlie (C) a vlhká pasta obsahujúca chlorid amónny (NH4Cl), chlorid zinočnatý (ZnCl2) a vodu (H2O).
O zinok funguje ako anóda, strata elektrónov; to je grafit funguje ako katóda, vedenie elektrónov na oxid manganičitý:
Anóda s polovičnou reakciou: Zn s → Zn2+(tu) + 2 a-
Semi-reakcia katódy: 2 MnO2 (aq) + 2 NH41+(tu) + 2e- → 1 Mn2O3s + 2NH3 (g) + 1 hodina2O(1)
Globálna reakcia: Zn s + 2 MnO2 (aq) + 2 NH41+(tu) → Zn2+(tu) + 1 Mn2O3 s + 2NH3 (g)
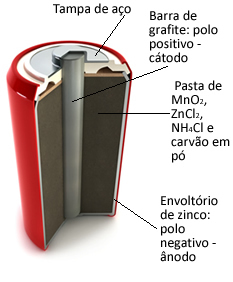
Tento typ batérie je vhodný pre zariadenie, ktoré vyžaduje ľahké a nepretržité vybíjanie, ako napríklad diaľkové ovládanie, nástenné hodiny, prenosné rádio a hračky.
Viac podrobností o pôvode, funkcii, životnosti, ddp, nebezpečenstvách a bezpečnostných opatreniach, ktoré je potrebné pri týchto batériách získať, nájdete v texte „Suchý stoh Leclanché”.
Teraz neprestávajte... Po reklame je toho viac;)
- Alkalínové batérie:
Jeho činnosť je veľmi podobná ako v prípade suchých buniek Leclanché, avšak jediný rozdiel je v tom, že namiesto chloridu amónne (čo je kyslá soľ), pridá sa silná zásada, hlavne hydroxid sodný (NaOH) alebo hydroxid draselný (KOH).
Polovica anódy: Zn + 2 OH → ZnO + H2O + 2e-
Semi-reakcia katódy: 2 MnO2 + H2O + 2e-→ Mn2O3 + 2 OH
Celková reakcia: Zn +2 MnO2→ ZnO + Mn 2O3

Alkalické batérie sú výhodnejšie ako kyselinové batérie v tom zmysle, že majú väčšiu výdrž zvyčajne poskytuje o 50 - 100% viac energie ako bežná batéria rovnakej veľkosti a navyše existuje menšie nebezpečenstvo netesnosti.
Sú určené hlavne pre zariadenia, ktoré vyžadujú rýchle a intenzívnejšie sťahovanie, ako sú rádiá, prenosné prehrávače CD / DVD a MP3, baterky, digitálne fotoaparáty atď.
Prečítajte si aj text Alkalínové batérie.
- Batérie lítium / oxid manganičitý:
Tieto batérie sú ľahké a vytvárajú veľké napätie (asi 3,4 V), preto sa často používajú v malých zariadeniach, ako sú hodinky a kalkulačky. Na rozdiel od predchádzajúcich prípadov ide o formát meny, ako je znázornené na nasledujúcom obrázku:

Anódou je lítium, katódou je oxid manganičitý a elektrolytom je soľný roztok:
Anóda s polovičnou reakciou: čítať →čítať+ + a−
Semi-reakcia katódy: MnO2 + prečítať+ + a−→MnO2(li)
Celková reakcia: Li + MnO2 → MnO2(li)
Autor: Jennifer Fogaça
Vyštudoval chémiu
Prajete si odkaz na tento text v školskej alebo akademickej práci? Pozri:
FOGAÇA, Jennifer Rocha Vargas. „Najčastejšie typy článkov a primárnych batérií“; Brazílska škola. Dostupné v: https://brasilescola.uol.com.br/quimica/tipos-pilhas-baterias-primarias-mais-comuns.htm. Sprístupnené 27. júna 2021.