aktívne izoméry alebo opticky aktívne izoméry (IOA) sú molekuly určitej chemickej látky, ktoré môžu vykonávať polarizáciu a odchýlku plán svetlo vpravo alebo vľavo. Ak chcete skontrolovať, či látka má alebo nemá aktívne izoméry, stačí skontrolovať, či je v jej štruktúrnom vzorci asymetrický uhlík:

Pri analýze reťazca znázorneného na obrázku vyššie môžeme vidieť, že centrálny uhlík má štyri rôzne ligandy (OH, H, CH3 a Cl), čo z neho robí a uhlík asymetrický, nazývaný tiež uhlík chirálna. Kedykoľvek má teda reťazec jeden alebo viac chirálnych uhlíkov, budú existovať aktívne izoméry.
Vy typy aktívnych izomérov(IOA) oni sú:
Pravák: Aktívny optický izomér, ktorý ohýba polarizované svetlo doprava;
Levogiro: Aktívny optický izomér, ktorý ohýba polarizované svetlo doľava.
Pozorovanie: Prítomnosť asymetrického uhlíka v štruktúrnom vzorci naznačuje, že látka musí mať ľavotočivý izomér a pravotočivý izomér. Nie je na nás, aby sme vedeli, ktorým smerom sa svetlo odrazilo, pretože prítomnosť chirálneho uhlíka už túto skutočnosť dokazuje. Polovica existujúcich molekúl je vždy ľavou rukou a druhá polovica pravou rukou.
Ľavostranné aj pravostranné molekuly akejkoľvek organickej látky majú vždy rovnaké fyzikálne vlastnosti (bod teplota topenia, teplota varu, hustota, rozpustnosť atď.), ale prítomné chemické aktivity (správanie v organizme) veľa rôznych. Príkladom je adrenalín. V tele pôsobí iba molekula adrenalínu levogyra, zatiaľ čo dextrogyra nie.
Teraz pozri štruktúrny vzorec bután-2-olovej látky a skontrolujte, či obsahuje alebo neobsahuje aktívne izoméry:
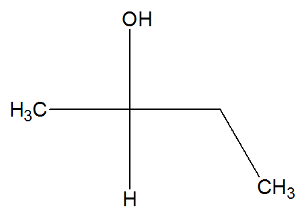
V štruktúre bután-2-olu môžeme pozorovať, že uhlík 2 má štyri rôzne spojivá (OH, H, CH3, CH2-CH3), takže ide o chirálny uhlík a predstavuje pravotočivý aktívny izomér a ďalší ľavotočivý aktívny izomér.
Výpočet aktívnych izomérov (IOA)
Holandský chemik Jacobus Henricus van't Hoff vyvinul vzorec, ktorý umožňuje výpočet počtu aktívnych izomérov (IOA), ktoré môže daná látka obsahovať. Pozri:
IOA: 2č
n: je počet chirálnych uhlíkov v štruktúrnom vzorci látky.
Postupujte podľa dvoch príkladov použitia vzorca Vant't Hoff:
Kyselina 5-dichlór-2,3-dihydroxy-hexándiová

V štruktúrnom vzorci zlúčeniny sú tri chirálne uhlíky alebo asymetrické, preto:
IOA = 2č
IOA = 23
IOA = 8
2,3,4,5-tetrahydroxyhexanal

V štruktúrnom vzorci zlúčeniny sú štyri chirálne uhlíky (červené šípky) alebo asymetrické, preto:
IOA = 2č
IOA = 24
IOA = 16
Pozorovanie: Existuje možnosť, že štruktúrny vzorec obsahuje dva asymetrické uhlíky, ktoré majú úplne rovnaké ligandy. Ak k tomu dôjde, uvažujeme vo výpočtoch iba 1 pre hodnotu n, nie 2. Pozri príklad:
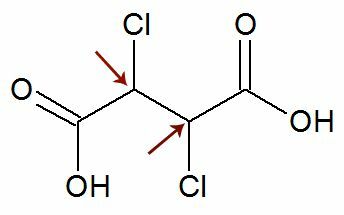
Páči sa mi to dva chirálne uhlíky oni sú rovná sa, považujeme iba za jednu uhlík vo výpočte:
IOA = 2č
IOA = 21
IOA = 2
Podľa mňa. Diogo Lopes Dias
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm
