Sulfonačné reakcie v alkánoch oni sú organické substitučné reakcie, uskutočňované s cieľom výroby sulfónové kyseliny (organické zlúčeniny, ktoré majú skupinu SO3H viazaný na atóm uhlíka alebo na uhlíkový reťazec) a voda (H2O).
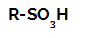
Štruktúrny vzorec kyseliny sulfónovej
Na uskutočnenie sulfonačnej reakcie dňa alkány, musíme zmiešať alkán (zlúčenina tvorená uhlíkovým reťazcom nasýteným iba atómami uhlíka a vodíka) a kyselina sírová (H2IBA4) koncentrovaný, podrobený zahrievaniu (∆).
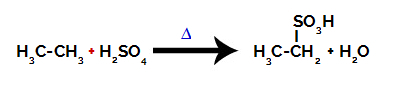
Chemická rovnica predstavujúca sulfonáciu alkánu s dvoma atómami uhlíka
Princípy sulfonačnej reakcie v alkánoch
Ako napr alkánová sulfonačná reakcia je to substitučná reakcia, máme v nej výmenu medzi menšími zložkami elektronegativita reaktantov, to znamená medzi alkánom a kyselinou sírovou. Alkán má vodík a kyselinu sírovú, sulfónovú skupinu.
Ďalej máme krok za krokom mechanizmus a sulfonačná reakcia v alkánoch. Ako príklad použijeme najjednoduchší alkán, metán (CH4):
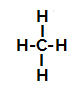
Štruktúrny vzorec metánu
1. krok: Narušenie väzby medzi hydroxylom (OH) a sírou (S) v kyseline sírovej.
Každá hydroxylová skupina prítomná v kyseline sírovej sa vyznačuje tým, že je elektronegatívnejšia. Pri zahrievaní počas reakcie je tendencia k prerušeniu väzby medzi hydroxylovou skupinou a sírou:
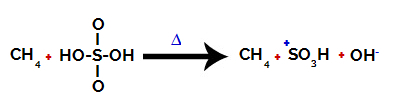
Narušenie väzby medzi sírou a hydroxylom
K prerušeniu väzby všetkých hydroxylových skupín však nedochádza z dôvodu elektronického prešmyku v štruktúre. Potom sa získa hydroxidový anión (OH).-) a sulfónový katión.
2. krok: Útok hydroxylovej skupiny na molekulu alkánu.
Potom hydroxyskupina (OH-) vykoná útok na alkán, ktorý spôsobí prerušenie väzby medzi uhlíkom a vodíkom (ktorý je krehkejší z dôvodu rozdielu elektronegativity medzi nimi).
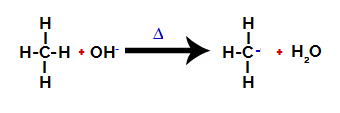
Prerušenie väzby medzi uhlíkom a vodíkom v alkáne
Poznámka: K narušeniu väzby medzi uhlíkom a vodíkom dôjde vždy najčastejšie na uhlíku s nižšou elektronickou hustotou alebo nábojom. Čím menej uhlíka má atóm vodíka alebo čím viac skupín je k nemu pripojených, tým nižšia je jeho elektrónová hustota. Takže máme:
Terciárny uhlík
Po rozbití väzby sa z alkánu stane uhlík s nedostatkom elektrónov (karbokácia). Hydroxidová skupina (OH)-) interaguje s uvoľneným vodíkom a vytvára molekulu vody.
3. krok: Útok vytvoreného radikálu na sulfónovú skupinu.
Na záver je sulfónová skupina napadnutá zvyškom alkánu a vzniká kyselina sulfónová.
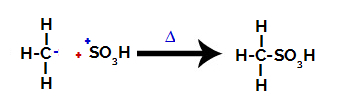
Štruktúry, ktoré interagujú a tvoria kyselinu sulfónovú
Príklady rovníc predstavujúcich sulfonačné reakcie v alkánoch
1. príklad: Sulfonácia propánu.
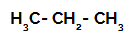
Štruktúrny vzorec propánu
Propán má dva primárne uhlíky a jeden sekundárny uhlík, ktoré majú rôzne náboje, pretože sú viazané na rôzne množstvá vodíka. Pretože uhlík je elektronegatívnejší ako vodík, majú tieto uhlíky rôznu hustotu elektrónov.
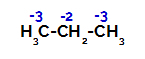
Rozloženie nábojov na každý atóm uhlíka propánu
Na primárnych uhlíkoch je náboj -3 (pretože je viazaný na tri vodíky) a na sekundárnom uhlíku je náboj -2 (pretože je viazaný na dva vodíky). Teda dôjde k prerušeniu väzby medzi uhlíkom a vodíkom, niekedy na uhlíku 1 (jednej molekuly), niekedy na uhlíku 2 (inej molekuly).
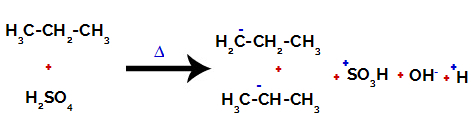
Prerušenie väzby medzi uhlíkom a vodíkom na rôznych uhlíkoch
Po zlomoch medzi väzbami, tak v kyseline sírovej, ako aj v alkáne, dochádza k tvorbe produkty s nahradením vodíka na uhlíku 1 sulfónovou skupinou, a to isté sa deje aj na uhlíku 2.
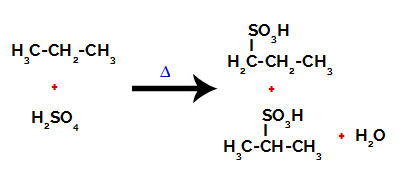
Produkty tvorené sulfonáciou propánu
2. príklad: Sulfonácia 2-metyl-butánu.

Štruktúrny vzorec 2-metyl-butánu
2-Metylbután má tri primárne uhlíky, sekundárny uhlík a terciárny uhlík, ktoré majú rôzne náboje a následne rôzne elektronické hustoty, ako je zrejmé z nasledujúcej štruktúry:
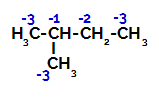
Distribúcia elektronických nábojov v 2-metyl-butáne
Preto existuje v 2-metyl-butáne niekoľko možností prerušenia väzby medzi uhlíkom a vodíkom, ktoré sa môžu vyskytovať na uhlíku 1 (molekule), uhlíku 2 (inej molekuly), uhlíku 3 alebo uhlíku 4. Je však pozoruhodné, že narušenie uhlíka číslo 2 je bežnejšie.
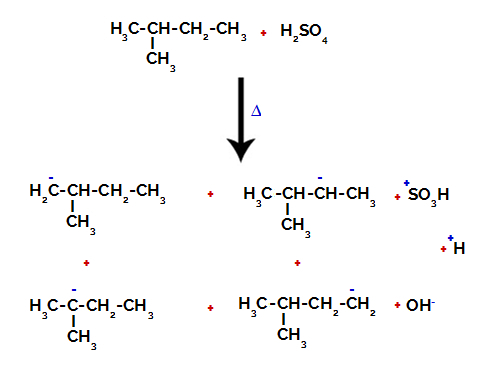
Prerušenie väzby medzi uhlíkom a vodíkom na rôznych uhlíkoch
Po rozbití väzieb, tak v kyseline sírovej, ako aj v alkáne, vzniká produkty s nahradením vodíka na uhlíku 1 sulfónovou skupinou a to isté sa deje s uhlík 2.

Produkty vzniknuté sulfonáciou 2-metyl-butánu
Podľa mňa. Diogo Lopes Dias
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm