Americký chemik Gilbert N. Lewis (1875-1946) navrhol pravidlo oktetu, ktoré hovorí:
„Atómy rôznych prvkov vytvárajú chemické väzby pri darovaní, prijímaní alebo zdieľaní elektrónov s cieľom získať elektronickú konfiguráciu ušľachtilý plyn, to znamená s 8 elektrónmi v poslednom obale (alebo s 2 elektrónmi v prípade atómov, ktoré majú iba jeden elektrónový obal, ako sa to vyskytuje u vodík). ““
V roku 1916 Lewis navrhol, aby zostali stabilné a dosiahli oktet alebo duet, prvky, ktoré tvoria molekulárne látky vykonávať zdieľanie elektrónových párov. Tieto látky sú tvorené iba atómami vodík, nekovy a polokovy, všetko s tendencia prijímať elektróny. Preto pre nikoho z nich neexistuje spôsob, ako darovať akýkoľvek elektrón (ako je to u kovov v iónových väzbách), ale každý potrebuje dostať, takže sa delí o svoje elektróny prostredníctvom kovalentnej väzby alebo molekulárne.
Gilbert Lewis teda navrhol spôsob, ako reprezentovať kovalentnú alebo molekulárnu väzbu, ktorá sa stala známa ako Lewisov vzorec
. Tiež sa volá elektronický vzorec alebo ešte Lewisova elektronická formula, pretože jeho hlavnou črtou je, že je ukazuje elektróny vo valenčnom obale každého atómu a tvorbu elektronických párov.Každý elektrón je reprezentovaný bodkou., ktorý obklopuje symbol zodpovedajúceho chemického prvku. Okolo prvku sú iba elektróny valenčnej škrupiny.
Ako ukazuje nasledujúca tabuľka, aby ste poznali množstvo elektrónov vo valenčnom škrupine, stačí poznať rodinu periodických tabuliek:

V Lewisovom vzorci každý zdieľaný elektrónový pár predstavuje chemickú (kovalentnú) väzbu, kde sa elektróny stretávajú v oblasti elektrosféry, ktorá je spoločná pre každý pár atómov, ktoré sú spojené. Preto sú v znázornení umiestnené vedľa seba.
Napríklad poďme zistiť, čo je Lewisov vzorec pre plynný vodík, ktorého molekulárny vzorec je: H2.
Každý atóm vodíka má vo valenčnom plášti iba jeden elektrón, pretože tento prvok patrí do rodiny 1 periodickej tabuľky. Každý musí prijať ďalší elektrón, aby bol stabilný, pričom v elektrónovom obale K sú dva elektróny. Zdieľajú teda svoje elektróny a obaja dostanú dva. Pozri:
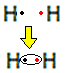
Toto je Lewisov vzorec pre molekulu plynného vodíka.
Kyslík má vo svojom elektrónovom obale šesť elektrónov, takže každý musí prijať dva ďalšie elektróny, aby bol stabilný, a to s ôsmimi elektrónmi. Preto Lewisov vzorec pre molekulu kyslíka je:

Uvidíte, že existujú dva odkazy, pretože existujú dva zdieľané páry.
Ďalšie príklady elektronických vzorcov molekulárnych látok nájdete nižšie:
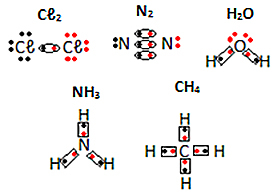
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm

