THE uhlíková hybridizácia typu sp stane sa to, iba ak vytvorí dve väzby pí (π) a dve väzby sigma (σ). V tomto prípade teda existujú dve možnosti: uhlík môže vytvoriť dve dvojité väzby alebo jednoduchú a trojitú väzbu, ako je uvedené nižšie:
Text „hybridizácia typu sp3”Podrobne ukazuje, ako prebieha hybridizácia uhlíka. Pamätajte si: hybridizácia je „zmiešanie“ čistých atómových orbitálov, ktoré vznikajú navzájom rovnocennými hybridnými atómovými orbitalmi, ale odlišnými od pôvodných čistých orbitálov. Stáva sa to teda na uhlíkových orbitáloch, ktoré boli pôvodne znázornené takto:
Pri príjme energie je však elektrón (predstavovaný šípkou) z obežnej dráhy 2 s povýšený na obežnú dráhu 2p:
Týmto spôsobom má uhlík štyri nepárové orbitaly, ktoré sú schopné vytvoriť štyri kovalentné väzby, nielen dve.
V prípade hybridizácie typu sp vieme, že dve väzby budú pi; vyskytujú sa na čistých orbitáloch „p“, zatiaľ čo ďalšie dva orbitaly, ktoré sú hybridmi sp, vytvoria zvyšné sigma väzby.
Priestorové znázornenie tejto hybridizácie medzi s a p orbitálom, ktoré vedie k vzniku hybridného sp orbitálu, je možné znázorniť takto:
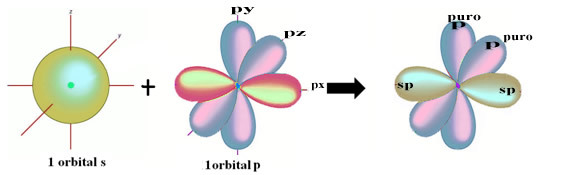
Na obrázku vyššie je zrejmé, že existujú dva čisté orbitaly, ktoré vytvoria väzby pí.
Aby ste pochopili, ako sa to deje, vezmime si ako príklad molekulu plynného kyanidu (HCN), ktorá sa v USA používa v plynových komorách pre väzňov odsúdených na trest smrti. Jeho štruktúrny vzorec je daný:
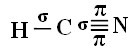
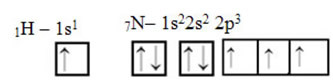
Pokiaľ ide o uhlík, jeho atómové orbitály už boli preukázané, teraz sa pozrite na vodíkové a dusíkové orbitaly:
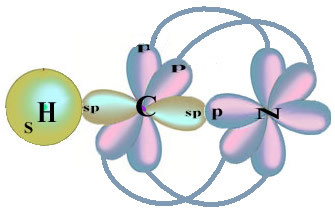
Všimnite si, že nepárový vodíkový orbitál, ktorý bude vykonávať väzbu sigma, je „s“, ktoré je priestorovo znázornené kruhom; a dusíkové orbitaly sú typu „p“, ktoré sú reprezentované tromi dvojitými vajcami (každý v priestorovom poli: x, y, z). Štruktúra molekuly HCN je teda znázornená takto:
Pokiaľ ide o typ väzieb existujúcich v tejto štruktúre formaldehydu, máme:
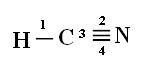
Pripojenia: 1 = σs-sp
2 = σp-sp
3 = 4 = πp-p
Autor: Jennifer Fogaça
Vyštudoval chémiu
Zdroj: Brazílska škola - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp.htm
